Межворсинчатый тромбоз что это
Что такое тромбоз? Причины, симптомы, диагностика, лечение, профилактика
Многие люди интересуются вопросом о том, что такое тромбоз. Это сосудистое заболевание, которое в той или иной мере связано с нарушением свертываемости крови, нарушением нормального кровотока. Тромб — это по большому счету кровяной сгусток, который перекрывает просвет сосуда. Естественно, подобная патология может привести к огромному количеству осложнений, вплоть до смерти пациента. Так каковы причины развития болезни? На какие симптомы нужно обратить внимание?
Что такое тромбоз?
Стоит отметить, что многие люди сталкиваются с таким диагнозом, как тромбоз. Тромб — это кровяной сгусток, образование которого является естественным процессом. Это приспособление организма, помогающее остановить кровотечение при повреждении сосудов.
Тем не менее иногда образование тромбов не связано с повреждением сосудистых стенок. В таких случаях речь идет о патологическом процессе. Ведь сгустки не ликвидируют «течь» в венах и артериях, а просто циркулируют по сосудам. Со временем тромбы могут увеличиваться в размерах, уменьшая просвет сосудов. Соответственно, нарушается кровоток, что сказывается на работе всего организма. Ткани не получают достаточного количества питательных веществ и кислорода, в результате чего наблюдаются их трофические изменения.
Патология при отсутствии своевременного лечения приводит к опасным осложнениям. Тромбоэмболия — это острое состояние, которое сопровождается отрывом кровяного сгустка и полной закупоркой жизненно важных сосудов (в частности, легочной артерии). Такая патология нередко развивается настолько быстро, что пациент погибает задолго до того, как попадет в отделение медицинской помощи. Именно поэтому важно знать о том, что такое тромбоз и какими симптомами он сопровождается.
Основные причины развития заболевания

Согласно сведениям, которые удалось получить исследователям, существует три основных причины, одновременное наличие которых практически в 100% случаев ведет к развитию тромбоза:
- нарушения целостности стенки сосуда (может быть вызвано как непосредственным механическим повреждением, так и воздействием на ткани инфекционных токсинов);
- резкое снижение скорости тока крови (подобное нарушение может быть результатом сдавливания сосудистой стенки, или, например, недостаточности венозных клапанов);
- повышение свертываемости крови (к причинам в данном случае можно отнести врожденные аномалии развития и структуры тромбоцитов, воздействие химических средств, включая и некоторые лекарственные препараты).
Выше описаны основные этиологические причины развития заболевания. Но к их появлению ведут определенные факторы, которые также стоит рассмотреть:
- чаще от тромбоза страдают в пожилом возрасте;
- вероятность развития заболевания не исключена и среди молодых людей, которые по той или иной причине вынуждены проводить длительное время в положении сидя, а также вести малоподвижный образ жизни; это связано с нарушением тока крови к сердцу и постепенным снижение тонуса мышц нижних конечностей;
- по той же причине тромбы образовываются у людей, которые в течение длительного времени должны соблюдать постельный режим;
- к факторам риска относят полостные операции;
- тромбоз может развиться у женщины после кесарева сечения;
- избыточный вес и ожирение также увеличивают вероятность развития заболевания;
- длительное применение лекарств, которые сказываются на свертываемости крови, может спровоцировать образование сгустка;
- курение вызывает спазм сосудов и, соответственно, также повышает риск развития патологии;
- к факторам риска относят установление имплантов (например, кардиостимуляторов) и длительную катетеризацию;
- длительное применение гормональных препаратов, включая противозачаточные средства, также может сказаться на состоянии сосудистой системы;
- затяжные инфекционные заболевания могут повреждать стенки сосудов, что провоцирует развитие тромбоза.
Довольно часто тромбоз развивается на фоне других заболеваний, включая, например, эндартериит, сахарный диабет и т. д.
Виды тромбоза
Естественно, существует несколько систем классификации данной патологии. Тем не менее в первую очередь заболевание разделяют в зависимости от того, какие сосуды оно поражает:
- Наиболее распространенным считается венозный тромбоз. Подобная патология сопровождается сворачиванием крови и образование сгустков в просвете вен. Чаще всего недуг поражает глубокие вены нижних конечностей, а вот тромбоз сосудов в верхнем отделе тела наблюдается реже. Кроме того, патология иногда развивается в поверхностных венах. В любом случае при отсутствии лечения количество сгустков увеличивается, тромбы распространяются по новым венозным магистралям.
- Тромбоз артерий, согласно статистике, диагностируется реже, но он намного опаснее. Дело в том, что давление и скорость тока крови в крупных артериях гораздо выше, а потому всегда существует вероятность отрыва сгустка с дальнейшей закупоркой просвета важных артерий. Даже временное прекращение кровотока ведет к ишемии органов. Например, отрыв тромба и закупорка коронарных артерий практически всегда заканчиваются инфарктом миокарда. Если в результате тромбоза перекрываются артерии, несущие кровь к головному мозгу, избежать инсульта практически невозможно.
Поражение глубоких вен и его особенности
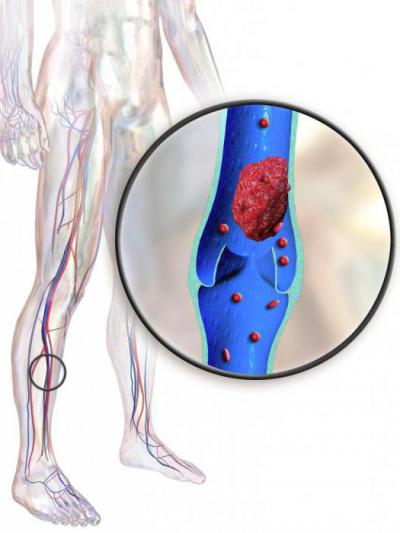
Чаще всего пациенты сталкиваются с диагнозом «тромбоз вен нижних конечностей». Симптомы, лечение, причины патологии — это важные вопросы. Данная разновидность заболевания считается одной из наиболее распространенных. Долгое время она может развиваться, не сопровождаясь никакими осложнениями, но последствия ее могут быть крайне опасными.
На ранних этапах болезнь сопровождается ощущением распирания в ногах, а также болезненностью. Сначала боль появляется во время физических нагрузок, но потом присутствует и в состоянии покоя. К другим симптомам можно отнести бледность кожных покровов, а также постоянную отечность. Качество жизни пациента постоянно ухудшается — даже короткая прогулка становится проблемой. Нередко на фоне тромбоза развивается флебит (воспаление венозных стенок), а также другие осложнения.
Тромбоз сосудов кишечника
Безусловно, тромбозу теоретически подвержены все сосуды человеческого организма. И в медицине довольно часто регистрируются случаи поражения верхнебрыжеечной артерии. При подобном заболевании от нарушения кровообращения страдает тонкая кишка и некоторые отделы толстой.
Диагностика заболевания может быть сопряжена с трудностями, ведь клиническая картина довольно смазана. На начальных этапах появляются боли в животе, тошнота и рвота, которые практически не связаны с приемом пищи, диарея, а также постепенное уменьшение массы тела. Отрыв тромба и закупорка сосуда вызывают быстропрогрессирующую ишемию тканей кишечника, что сопровождается сильной, резкой болью в животе. Данное состояние нередко требуется срочного хирургического вмешательства.
Острый тромбоз и его признаки
Патология может развиваться многие недели и даже месяцы, не вызывая серьезных изменений в состоянии пациента. Поэтому люди, как правило, обращаются к врачу уже при появлении осложнений.
Образование крупного тромба вызывает экстренное состояние под названием «острый тромбоз», симптомы которого трудно не заметить. Нарушение кровообращения в тканях, выраженное кислородное голодание сопровождаются следующими симптомами:
- острая боль, возникающая в пораженной конечности;
- бледность кожных покровов;
- кожа над пораженным участком становится прохладной на ощупь;
- наблюдается нарушение тактильной и болевой чувствительности;
- развитие мышечной контрактуры;
- нарушение двигательной активности.
Наличие подобных нарушений — веское основание немедленно обратиться к врачу.
Тромбоз и тромбоэмболия
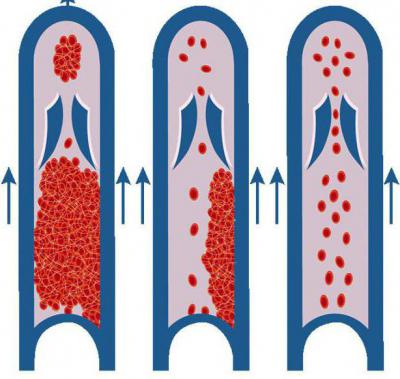
Не стоит недооценивать опасность тромбоза. Тромбоэмболия — это крайне опасное состояние. Это не самостоятельная болезнь, а скорее одно из последствий тромбоза. По тем или иным причинам сгусток крови попадает в открытое кровяное русло, после чего полностью закупоривает сосуд. Результатом эмболии является кислородное голодание и быстро развивающаяся ишемия тканей.
Отрыв тромба и попадание его в сердечные сосуды приводит к инфаркту. Закупорка артерий, несущих кровь к головному мозгу, приводит к инсульту и прочим поражениям нервной системы. В большинстве случаев прогноз для пациентов неблагоприятный, так как далеко не каждому больному удается вовремя получить срочную медицинскую помощь.
Диагностика заболевания
Процесс диагностики включает в себя несколько основных этапов. Конечно, сначала врач проводит внешний осмотр и собирает анамнез, но для определения локализации тромбоза необходимы другие исследования. В частности, одним из самых информативных тестов является ультразвуковая допплерография. Например, подобная процедура позволяет диагностировать венозный тромбоз в венах нижних конечностей. Есть и другие способы исследования, включая флебографию, компьютерную ангиографию, плетизмографию и т. д.
Также назначаются коагулологические тесты, с помощью которых можно оценить степень и скорость свертываемости крови. В том случае, если есть подозрение на наличие аутоиммунных тромбозов, дополнительно проводят иммуноферментные анализы крови.
Современные методы лечения
Безусловно, важным вопросом для каждого пациента являются методы лечения, которые может предложить современная медицина. Терапия, разумеется, зависит от степени развития тромбоза и наличия осложнений.
Не один десяток лет для профилактики тромбоза и ишемической болезни применяется аспирин (ацетилсалициловая кислота), однако длительный его прием может привести к проблемам со стороны желудочно-кишечного тракта, таким как изжога, гастрит, тошнота, боли в желудке и т.д.
Чтобы снизить риск подобных нежелательных последствий, необходимо принимать средства в специальной кишечнорастворимой оболочке. Например, можно воспользоваться препаратом «Тромбо АСС®»*, каждая таблетка которого покрыта кишечнорастворимой пленочной оболочкой, устойчивой к воздействию соляной кислоты желудка и растворяющейся лишь в кишечнике. Это позволяет избежать прямого контакта со слизистой оболочкой желудка и снизить риск развития изжоги, язвы, гастрита, кровотечения и т.д.
Кроме того, комплексное лечение включает в себя прием противовоспалительных средств, а также препаратов, которые поддерживают тонус стенок венозных сосудов. Также полезной является физиотерапия. Важно подкорректировать рацион, а также поддерживать физическую активность, заниматься посильной физической работой.
В некоторых случаях нельзя обойтись без хирургического вмешательства. Операцию назначают в случае образования крупных тромбов и серьезных нарушений кровотока.
Профилактические мероприятия: как предупредить развитие болезни?

Зная о том, что такое тромбоз и под воздействием каких факторов он развивается, можно выделить несколько профилактических мер, позволяющих снизить риск развития заболевания.
Что касается медикаментозного лечения, то в послеоперационный период пациентам назначают лекарства, разжижающие кровь — это предотвращает образование сгустков. Больным, вынужденным соблюдать постельный режим, необходим регулярный лечебный массаж, который устраняет застой крови.
Важным моментом является и питание — во избежание развития атеросклероза и тромбоза нужно уменьшить количество животных жиров в рационе. При застое крови в венах нижних конечностей поможет ношение специального компрессионного белья. И конечно же, не стоит забывать о физической активности — это единственный способ поддерживать тонус мышц и нормализовать кровообращение.
Возможно ли лечение народными средствами?
Народная медицина предлагает множество средств, способных разжижать кровь и, соответственно, препятствовать образованию тромбов и растворять уже имеющиеся. Например, довольно эффективным считается прием настойки белой лапчатки или каштана. Их можно приготовить самостоятельно или приобрести уже готовые лекарства в аптеке.
Можно приготовить лекарство из цитрусовых и чеснока. Для этого нужно измельчить два лимона (с помощью мясорубки) вместе с кожурой. Туда же добавить очищенный измельченный чеснок (одну головку средних размеров). Ингредиенты перемешать, залить небольшим количеством кипяченой охлажденной воды, после чего накрыть крышкой и оставить в холодильнике на три дня. После этого рекомендуется процедить настой и принимать его по столовой ложке трижды в день.
Стоит понимать, что домашние лекарства могут быть использованы только в качестве вспомогательного средства и только после предварительной консультации с врачом.
* Имеются противопоказания, перед применением необходимо проконсультироваться со специалистом.
Патология, обусловленная нарушением плодово-плацентарного кровообращения
Межворсинчатый тромбоз встречается в 3-50% случаев зрелых плацент.
Они образуются вследствие кровотечения из плодовых сосудов ворсин в межворсинчатое пространство при разрыве истонченного СТФ, покрывающего расширенные капилляры ворсин (такие поля истончения часто обнаруживаются в нормальных плацентах после тщательного осмотра). Макроскопически: свежие тромбы — округлые или овальные, мягкие, темно-красные, диаметром 2-5 см, локализуются в любой части плаценты. Старые тромбы — плотные, белые, крошатся. Микроскопически: свежие тромбы построены из фибрина и эритроцитов как материнских, так и плодовых (смешение материнской и плодовой крови инициирует тромбообразование, особенно если два кровоснабжения несовместимы). После тщательного исследования в них обнаруживаются и ядерные эритроциты. Ворсины отсутствуют. Обычно межворсинчатые тромбы не оказывают влияния на функцию плаценты.
При аномалии плодовых сосудов (васкулопатиях) поражаются крупные сосуды хориальной пластинки и стволовых ворсин, ведущий морфологический признак — частичное или полное закрытие просвета разрастающейся соединительной тканью.
Тромбоз плодовых артерий (тромботическая васкулопатия) наблюдается в сосудах плодовой пластинки или стволовых ворсин. Макроскопически: в плодовой пластинке видны бледные участки треугольной формы, тромбированные сосуды, как правило, не видны. При тщательном осмотре и пальпации артерий плодовой поверхности (артерии почти всегда лежат над венами) можно обнаружить бледно окрашенные, плотные и иногда явно обызвествленные сегменты тромбированных сосудов. Микроскопически: в макроскопически видимых бледных участках выявляются поля аваскулярных ворсин с гиперплазией стромы и увеличенным количеством СУ. Межворсинчатое пространство пустое, перивиллезный фибриноид отсутствует. В верхней части таких очагов в плодовых артериях стволовых ворсин видны тромбы. Истинная частота тромбоза плодовых сосудов неизвестна, так как это повреждение может быть легко пропущено, если не знать о его существовании и если каждый микропрепарат не будет тщательно исследован. Тромбоз стволовых ворсин отмечается в 10% случаев плацент при сахарном диабете. Патогенез неясен.
Одиночные или множественные тромбы, выключающие ≥ 30% площади плаценты, не имеют клинического значения. В редких случаях выраженная (40-50%) потеря ворсин вследствие множественного тромбоза плодовых сосудов может быть причиной антенатальной смерти плода. Тромбы в этих случаях уже организованы.
Облитерирующий эндартериит характеризуется сужением и/или почти полным закрытием просвета сосудов стволовых ворсин. Термин «эндартериит» является ошибочным, так как это не воспаление, а результат утолщения (гиперплазии) и редупликации интимы сосуда. Очаговый процесс встречается в 10% случаев зрелых нормальных плацент, но более часто и интенсивнее он наблюдается при преэклампсии, гипертензии, СД, ГБН, курении, сифилисе, ЦМВИ и краснухе. Гиперплазия интимы обусловлена гемодинамическими нарушениями, которые наблюдаются в плодовом кровообращении вследствие маточно-плацентарной ишемии. В дальнейшем развивается редукция плодового кровообращения в ворсинах и фиброз их стромы.
Фибромышечный склероз (коллапс-склероз) — концентрическое сужение просвета крупных сосудов хориальной пластинки и стволовых ворсин при местных или общих нарушениях перфузии фетальных сосудов. Характеризуется выраженной гиперплазией фиброзной ткани в интиме и мышечной — в медиа. Может быть локализованным или генерализованным. Чаще поражаются артерии. Локализованный фибромышечный склероз наблюдается по периферии старых массивных инфарктов, дистальнее обтурирующих тромбов сосудов пуповины, хориальной пластинки и стволовых ворсин, в ворсинах, замурованных в фибриноиде. Генерализованный фибромышечный склероз отмечается в плацентах при длительной антенатальной смерти как реактивный феномен на недостаток кровотока после смерти плода.
При геморрагическом эндоваскулите (эндоваскулозе, ГЭ) поражаются плодовые стволовые сосуды, их ветви и даже капилляры ворсин. В начальных стадиях выявляются интрамуральные кровоизлияния, некрозы интимы. В дальнейшем на месте кровоизлияний и некроза появляются сидерокальцификаты, разрастается соединительная ткань с утолщением интимы и облитерацией просвета. В просвете встречаются свежие или старые тромбы. Процесс может быть очаговым и диффузным. Гемморагический эндоваскулит сочетается с виллитами в 60% случаев. Они наблюдаются при ЗВУР и мертворождаемости (в 50% случаев), поражениях нервной системы у 40% выживших, 50% — при последующих беременностях, обычно с худшим прогнозом. Причины ГЭ не совсем ясны. Некоторые авторы считают его следствием инфекции, так как вирусные или микоплазменные частички обнаруживаются при электронной микроскопии в 50% случаев. Другие полагают, что это результат индуцированной гипоксией вазоконстрикции.
Патогенетические и патоморфологические изменения отдельных органов и систем при гестозе
Сущность многосторонних изменений при гестозе заключается прежде всего в первоначальном поражении сосудистой системы плаценты и повышении ее проницаемости для антигенов плода. Сосудистая система плаценты является линией первой защиты против проникновения антигенов плода в кровоток матери.
Известно, что с 20 нед беременности начинается активный рост промежуточных ворсин и смена типа стромы на более плотную. Недостаточность второй волны инвазии цитотрофобласта нарушает процесс дальнейшего формирования ворсин плаценты. Развивается вариант хаотичных и склерозированных ворсин. Происходят беспорядочное ветвление мелких ворсин, которые не соответствуют типичным терминальным ворсинам, гиповаскуляризация этих ворсин, избыток соединительной ткани в строме, что препятствует их синусоидальной трансформации. Отсутствуют типичные синцитиокапилляры мембраны и компенсаторный ангиоматоз. Доминирует стромальный компонент при явном отставании развития капиллярного русла, а также эпителиального покрова ворсин.
Вариант хаотичных склерозированных ворсин сопровождается повышенной проницаемостью плацентарного барьера для антигенов плода.
Наличие фибриноида, расположенного между материнской кровью и плацентарными тканями, имеет материнское происхождение, так как чаще всего фибриноид обнаруживают на поверхности поврежденного синцитиотрофобласта. По современным представлениям фибриноид представляет собой не только продукт секреторной деятельности цитотрофобласта гликопротеидовой природы, но и антигены плода, протеины материнской крови (адгезирующие белки), а также компоненты экстрацеллюлярного матрикса. Накопление фибриноида более выражено в центральной части плаценты, в краевых зонах, где имеется завихрение тока материнской крови. Фибриноид в составе базальной мембраны осуществляет защитный иммунологический механизм, не допуская контакта с фетальными клетками. Межворсинчатый фибриноид является продуктом тесного взаимодействия материнских компонентов крови (лизированные эритроциты, тромбоциты, фибрин, плазма) и плацентарных клеточных компонентов. Основная задача межворсинчатого фибриноида заключается в закрытии дефектов эпителиального покрова ворсин. Обнаружение внутриворсинчатого фибриноида в микроканалах плаценты при гестозе отражает прорыв матрикса стромы ворсин и выраженную плацентарную недостаточность [Милованов А. П., 1999].
Патология структуры плаценты сопровождается при гестозе маловодием, что свидетельствует о плацентарной недостаточности. Из известных клинико-морфологических форм маловодия (париетальный мембранит, атрофия децидуальных оболочек) для гестоза характерна дизонтогенетическая форма — сохранение мезенхимальных ворсин плодного пузыря, что является подтверждением неполноценности первой и второй волны инвазии синцитиотрофобласта в стенки децидуальных сосудов (6—8 и 14—16 нед гестации).
А. П. Милованов (1999) доказал, что при этой патологии имеет место персистенция мезенхимальных ворсин, неполное слияние dicidua capsularis с эндометрием матки. Ворсины с плотной гиалинизированной стромой являются препятствием для транспорта воды и мочевины из околоплодной жидкости в капилляры матки, а также блокируется транспорт пролактина в сторону околоплодного пространства.
Нередко гестоз развивается на фоне хронической инфекции в матке. В таких случаях олигогидрамнион сопровождается воспалительным поражением плодных оболочек, некрозом амниотического эпителия оболочек и плаценты, которые продуцируют компоненты амниотической жидкости. Из-за воспалительных изменений возможен локальный разрыв плодных оболочек (высокий боковой разрыв и подтекание околоплодных вод). Массивная гибель амниотического эпителия приводит к существенным сдвигам гормонально-простагландинового баланса, дефициту синтеза простагландинов класса Е и вазоконстрикторному воздействию на сосуды матки. Возникает также недостаточность пролактина, который участвует в гормонально-простагландиновой регуляции. Все эти изменения вызывают преждевременное прерывание беременности.
О. В. Зайратьянц и соавт. (2002) подчеркивают, что наиболее характерным признаком изменения плаценты при гестозе является массивное отложение фибриноида в межворсинчатом пространстве, выраженные компенсаторно-приспособительные реакции в плаценте (в 100 % случаев), патологическая незрелость — вариант с преобладанием хаотичных незрелых ворсин (73—80 %), атрофия и склероз крупных ворсин (60 %). Авторы считают, что современная интенсивная терапия (массивная инфузионная, антиагрегантная и антикоагулянтная) приводит к тому, что в органах-мишенях (головной мозг, печень, почки) значительно реже наблюдаются обширные инфаркты, кровоизлияния и некрозы, но всегда сохраняются морфологические признаки гестоза в маточно-плацентарном ложе и плаценте. При этом морфологические изменения в плаценте коррелируют со степенью тяжести гестоза.
Таким образом, при гестозе макроскопически выявляют плаценты небольших размеров с наличием геморрагических (красных) инфарктов. При микроскопическом исследовании обнаруживают:
• тромбозы сосудов и межворсинчатых пространств;
• признаки склероза и облитерации, сужение просвета, атероматоз артерий;
• отек стромы ворсин;
• увеличение количества фибриноида, который «замуровывает» часть ворсин;
• некротические изменения в плаценте;
• преобладание хаотичных склерозированных ворсин;
• признаки интенсивных компенсаторных реакции (ангиоматоз, синцитиальные почки, рост новых молодых ворсин, расширение диаметра капилляра в ворсине).
Однако при быстром росте дополнительных ворсин в условиях сниженного кровоснабжения и нарушенного кровотока капилляр ворсины сохраняет центральное расположение и не приближается к стенке, как это имеет место в зрелых терминальных ворсинах. Поэтому обменные процессы, диффузия кислорода и углекислого газа, проникновение необходимых питательных веществ полностью не компенсируются.
Опережающее (преждевременное) созревание плаценты происходит в условиях изосенсибилизации (образования антител). И если при нормальной беременности плацента нейтральна в антигенном отношении, в условиях развившегося гестоза она становится иммунологически активной. Появляются специфические антитела к плаценте, которые в конечном итоге могут способствовать ее отторжению по типу отторжения чужеродного трансплантата (преждевременная отслойка плаценты).
Преждевременная отслойка плаценты относится к специфическим осложнениям гестоза, при этом возможна тотальная отслойка всей плаценты и пропитывание матки жидкой кровью, что всегда свидетельствует об исключительной тяжести гестоза.
При гестозе в различной степени снижаются функции плаценты: дыхательная (гипоксия плода), питательная (гипотрофия, задержка внутриутробного развития), выделительная (маловодие), защитная (риск внутриутробного инфицирования), гормональная.
Снижение продукции гормонов белковой природы (ХГ, ПЛ), а также специфических белков беременности отражает ослабление взаимной адаптации матери и плода.
В субплацентарной зоне миометрия имеют место свидетельства неполной гестационной перестройки маточно-плацентарных эндометральных и миометральных сегментов. Спиральные сосуды плацентарного ложа сохраняют мышечный и эластический слои либо на всем протяжении сосуда, либо в его отдельных участках. Эти изменения всегда являются доказательством гестоза.
Нарушение созревания плаценты не в соответствии с должным гестационным сроком сопровождается прекращением нейтрализации иммунных комплексов, что еще более усугубляет опасность преждевременной отслойки плаценты и внутриутробной смерти плода. Эти обстоятельства не позволяют врачу применять тактику, направленную на лечение угрозы преждевременных родов и дальнейшее сохранение беременности. Длительное течение гестоза может привести к тяжелым и нередко необратимым дистрофическим изменениям в жизненно важных органах и регулирующих системах, что опасно для жизни женщины.
Вторым типичным звеном поражения при гестозе являются почки. Недаром много лет поздний гестоз называли нефропатией. Почки поражаются раньше других и больше других органов. Их изменения могут носить первичный характер, если до беременности женщина была здоровой, или вторичный, когда изменения, характерные для гестоза, наслаиваются на уже существующую патологию, иметь обратимый и необратимый характер. Нередко скрытое заболевание почек впервые проявляется во время беременности.
Иммунные комплексы, содержащие компонент комплемента С3b, откладываются на стенках гломерулярных капилляров. Происходит контактная активация фактора XII, системы комплемента и калликреинкининовой системы. Нарушается физиологическая роль почек в регуляции состояния гемостаза. Инициируется процесс микротромбообразования с внутрисосудистой коагуляцией. На определенном этапе развития гестоза этот процесс становится генерализованным. О выраженных нарушениях в микроциркуляторном русле почек свидетельствуют данные патоморфологических исследований у женщин, умерших от эклампсии. Выявлены множественные фибриновые микротромбы в просвете капилляров клубочков и в приводящих артериолах.
При тромбировании капиллярных клубочков нарушается доставка крови к структурным компонентам нефрона. Постепенно (а иногда быстро!) развиваются дистрофические и некротические изменения в системе нефрона. Наблюдаются изменения по типу зернистой дистрофии в эпителии проксимальных канальцев.
При массивном тромбозе, когда в процесс вовлечено большинство капиллярных клубочков, развивается коагуляционный некроз проксимальных канальцев. Вокруг некротизированных канальцев происходит расширение сосудов, кровоизлияния. По мере прогрессирования гестоза в процесс вовлекается весь нефрон, строма и окружающие сосуды. Все это может привести к необратимому кортикальному некрозу и далее — к почечной недостаточности.
Основные изменения в почках при позднем гестозе сводятся к следующему.
▲ Иммунное поражение сосудов по типу эндотелиоза. Стенка сосудов утолщается, просвет суживается. Артериальное кровоснабжение почек снижается. Ишемическая почка в большом количестве продуцирует ренин, который, соединяясь с белками плазмы, превращается в сильный прессорный амин — ангиотензин II. Высокая концентрация ангиотензина II и других прессорных факторов в крови вызывает длительную и «жестокую» периферическую вазоконстрикцию и артериальную гипертензию.
▲ Вторым важным компонентом является высокая проницаемость сосудистой стенки и выход жидкости из сосудистого русла в межтканевое пространство. Это приводит к уменьшению объема циркулирующей крови (ОЦК), объема циркулирующей плазмы (ОЦП) и отекам.
▲ Нарушаются текучесть, реологические свойства крови за счет ДВС-синдрома. В почках образуются участки ишемических и геморрагических инсультов.
▲ Поражение клубочков и канальцев почек идентично иммунному воспалению. Снижается клубочковая фильтрация (олигурия), увеличивается проницаемость клубочков для белка (протеинурия). Постепенно нарушаются все основные функции почек: фильтрационная, концентрационная, реабсорбционная, водовыделительная, гормональная и регуляторная. Снижение этих свойств нарушает регуляцию в организме беременной артериального давления, ОЦК, ОЦП, осмолярность плазмы, плотность и кислотность мочи.
▲ Первичным ответом почки на снижение кровоснабжения является перераспределение жидкой части крови, увеличение внеклеточного сектора воды, повышение сопротивления почечных сосудов. В связи с этим нарушается концентрация мочи, снижается диурез, особенно днем в вертикальном положении женщины. Снижается толерантность к водной нагрузке.
Для начала развития гестоза характерны снижение диуреза, никтурия, повышение относительной плотности мочи. Более поздними признаками являются олигурия, снижение относительной плотности мочи, протеинурия, гипонатриемия, гипокалиемия, защелачивание мочи, которое способствует развитию грамотрицательной микрофлоры и инфицированию мочевыводящих путей.
Необходимо принимать во внимание, что по мере длительного течения гестоза, развития нефротического синдрома (протеинурия, гипоальбуминемия, гиперхолестеринемия, отеки) или наслоения гестационной патологии на предшествующее заболевание типа хронического гломерулонефрита резко ослабляется кровоснабжение почек, особенно перфузия коркового вещества почек. Это может повлечь за собой возникновение острой почечной недостаточности (ОПН), кортикального некроза, тромбоза почечных вен, фокально-сегментарного гиалиноза и других крайне тяжелых, нередко смертельных осложнений.
В генезе нарушений функции почек при гестозе значительную роль играют критические показатели системного артериального давления. Гипертензия выше 170/100 мм рт. ст., а также артериальная гипотония ниже 80 мм рт. ст. нарушают ауторегуляцию почечного кровотока. Гиперкоагуляция и гиперагрегация в сочетании со снижением почечного кровотока вызывают уменьшение артериальной перфузии почек, гипоксию нефрона, отек интерстиция, снижение скорости клубочковой фильтрации.
В корковом веществе почек вторично снижается синтез простагландинов Е2, простациклина, влияющих на уровень ренина. Высокое содержание тромбоксана А2 не только уменьшает кровоток, но и вызывает клеточное набухание канальцев, их обструкцию, а иногда их разрыв.
В результате снижения микроциркуляции и усиления патологической гиперкоагуляции нарушается функция надпочечников. Первоначально имеет место персистирующая гиперпродукция катехоламинов, 17-ОКС, повышение продукции АДГ, а в более тяжелой стадии гестоза — гиперфункция надпочечников сменяется их гипофункцией и далее развивается фаза истощения (гипоплазия надпочечников).
По мере усугубления иммунных и нейроэндокринных нарушений, генерализации ЦИК не только в плаценте, но и других жизненно важных органах усугубляются все более выраженные симптомы: артериальная гипертензия, протеинурия, задержка жидкости, снижение диуреза, отеки, гипопротеинемия.
При патоморфологическом исследовании почек при гестозе выявлено увеличение их массы, билатеральные некрозы коркового вещества, резко очерченные границы мозгового и коркового вещества.
Микроскопически находят чаще всего набухание эндотелия капилляров клубочков, отложение фибрина в субэндотелиальном слое, пролиферацию мезангиальных клеток, некроз эпителия извитых канальцев, тромбоз капилляров клубочков, очаговую лимфоцитарную инфильтрацию стромы [Зайратьянц О. В. и др., 2002].
Таким образом, патоморфологические данные подтверждают, что повреждения почек при гестозе включают 2 звена: иммунное и гемокоагуляционное. Фиксация ЦИК на мембранах клеток эндотелия и субэндотелиального слоя клубочков приводит к повышению сосудистого сопротивления и снижению кровотока. Иммунное воспаление эндотелия запускает процесс внутрисосудистого свертывания крови с отложением фибрина и развитием внутрисосудистого микротромбоза. Повреждение почек при гестозе касается прежде всего клубочков («клубочковый капиллярный эндотелиоз») [Shechan H. L., 1990].
При иммунофлюоресцентной микроскопии в почечных клубочках при гестозе обнаружено отложение фибрина, IgG, IgA, IgM (обзорные данные Т. Н. Ганзен, 1982), что подтверждает иммунологические механизмы их повреждения. При этом при тяжелом течении гестоза имеет место уменьшение количества Т- и В-клеток, а также снижение их функциональной активности.
Снижены также показатели гуморального иммунитета, т. е. способность синтезировать антитела.
При тяжелом течении гестоза в ИК количественно преобладают антигены плода над содержанием антител материнского генеза. В ИК активируются компоненты комплемента С5—С9, обладающие цитотоксическим и цитолитическим действием на клетки тканей.
Рядом исследователей неоднократно доказана депрессия гуморального иммунитета при гестозе, что в сочетании с физиологическим снижением клеточного иммунитета делает больных практически беззащитными к инфекции.
Печень является главным органом, обеспечивающим детоксикацию в организме, в том числе элиминацию ЦИК.
При массивном поступлении антигенов плода в кровоток матери или длительном их проникновении через плаценту в течение 1,5—2 мес длительно текущий гестоз, звездчатые ретикулоэндотелиоциты перенасыщаются ИК и перестают их элиминировать. Создаются условия для длительной циркуляции ИК, что способствует их отложению в тканях. Мелкие и слабофиксирующие комплемент комплексы медленно удаляются из циркуляции.
Задержка элиминации ЦИК в печени происходит также при ее хроническом воспалении. При накоплении ЦИК в печени имеет место так называемое комплементзависимое иммунное слипание сенсибилизированных клеток с ретикулоэндотелиоцитами, что сопровождается гемолитической анемией и тромбоцитопенией. Это самые тяжелые формы гестоза, когда имеет место преимущественное иммунное поражение печени или чаще всего одновременное поражение почек и печени (печеночно-почечный синдром). Возможно, в этот процесс вовлекаются поражение альвеол и разрушение сурфактантной системы легких (почечно-печеночно-легочный синдром). И чаще всего это происходит при активации всех компонентов комплемента от С1 до С9, когда происходит сборка цитолитического мембранатакующего комплекса С5—С9 на клеточных мембранах печени почек, легких. Важное значение в формировании этого комплекса играет недостаток ионов Mg 2+ .
Фиксация ЦИК на мембранах гепатоцитов вызывает их иммунное воспаление. Отложение повышенного количества ИК в печени может быть обусловлено рядом причин, основными из которых являются:
• дефекты в системе макрофагов и системе активированного комплемента;
• повышенная проницаемость сосудистой стенки;
• уменьшение количества тромбоцитов;
• снижение метаболической активности печени, в том числе способности к синтезу гидролитических ферментов, направленных на то, чтобы не допустить фиксации ИК на длительное время в печени или почках.
В кавказских популяциях нередко встречается дефицит ранних компонентов системы комплемента (С1—С2), что может запустить сборку мембранатакующего комплекса и очень тяжелое течение гестоза. ИК в таких случаях откладываются не только в печени, почках, легких, но и коже (по типу аллергического дерматита). Это приводит к стимуляции образования новых ИК и усугублению тяжести гестоза.
В результате системных сосудистых нарушений при гестозе в печени развиваются острый эндотелиоз, микротромбоз, расстройство микроциркуляции, повышение проницаемости сосудистой стенки, отек периваскулярных зон.
Просвет сосудов печени сужается за счет отложений фибрина на клетках эндотелия. Тромбозы и кровоизлияния деформируют колонки печеночной ткани, нарушают ее функцию.
Снижаются белковообразующая, детоксикационная, обменная и другие функции печени. Если наибольшое повреждение происходит в гепатоцитах, синтезирующих белки и прокоагулянты, может произойти их жировое перерождение (острый жировой гепатоз).
Повреждение всей паренхимы, эндоплазматической сети печени системы макрофагов, где происходит разрушение иммунных комплексов, вызывает тяжелую интоксикацию, нарушение конъюгации билирубина. Возможен выброс ферментов в кровь. Это наиболее тяжелое повреждение вызывает ферментную аутоагрессию, разрушение тромбоцитов и эритроцитов (HELLP-синдром).
При более легком течении гестоза существенного снижения функций печени не выявлено, тогда как при пре- и эклампсии обнаружены подавление метаболизма и задержка выведения лекарств.
При морфологическом исследовании печени у умерших от эклампсии женщин отмечается перипортальный (околоворотный) некроз, субкапсулярные кровоизлияния, массивное отложение фибрина в синусоидальных капиллярах печени. Редко, но возможен разрыв капсулы печени с массивным (всегда смертельным) кровотечением в брюшную полость.
Морфологической основой печеночной недостаточности являются дистрофические изменения паренхимы печени либо ее жировое перерождение, нарушение обмена холестерина в гепатоцитах (гиперхолестеринемия), при котором происходит атероматоз артерий.
Следует подчеркнуть, что наиболее распространенные биохимические исследования функции печени и печеночные пробы позволяют выявить только тяжелую патологию, тогда как более легкие формы поражения остаются незамеченными.
При гестозе процессы аэробного окисления в печени заменяются анаэробным гликолизом. Учитывая, что печень является единственным местом синтеза альбуминов, фибриногена, протромбина и других прокоагулянтов, при повреждении ее паренхимы развиваются соответствующие дефициты: гипопротеинемия, гипоальбуминемия, снижение коагуляционного потенциала крови. Печеночная недостаточность при длительно текущем гестозе сопровождается одновременным развитием почечной недостаточности (печеночно-почечный синдром) и/или острым панкреатитом.
К летальному исходу приводят прогрессирующая интоксикация, коагулопатические кровотечения, почечно-печеночная кома.
При одновременном тяжелом поражении сосудов печени и почек (нефрогепатопатия) ситуация утяжеляется разрушением и гемолизом эритроцитов (за счет множественных нитей фибрина, выпавших вдоль стенок капилляров, венул, артериол). Гемолитическая анемия вызывает образование прямого билирубина, вывести который, т. е. связать с глюкуроновой кислотой, печень полностью не способна.
При некрозе печеночной паренхимы может иметь место гиперкалиемия, вызывающая клинические симптомы неврологического характера (гипорефлексия, парестезии, беспокойство, одышка, экстрасистолия), а также признаки тяжелой интоксикации.
Результатом иммунной и ферментной аутоагрессии, расстройства внутриорганной микроциркуляции, тяжелых нарушений метаболизма ацинарных клеток может явиться геморрагический или деструктивный панкреонекроз. Бурная активация собственных протео- и липолитических ферментов (трипсина, химотрипсина) сопровождается ферментативным аутолизом ацинарных клеток. Деструкция мембранных клеточных структур сопровождается выбросом из гранул секрета не в просвет протоков, а в интерстициальное пространство, откуда ферменты всасываются в кровь и лимфу. Активированный трипсин «включает» в цепь нарушений калликреин-кининовую систему, высвобождает гистамин и серотонин, что сопровождается расстройством гемо- и лимфоциркуляции, образованием некрозов.
Помимо острой почечно-печеночной недостаточности, при деструктивном панкреатите возникают гипергидратация легких, миокардиодистрофия, асцит.
Для гестоза характерна неодинаковая степень поражения сосудов разных органов, поэтому возникают различные клинико-морфологические варианты осложнения с преимущественным поражением сосудов почек и печени.
Источники: http://fb.ru/article/255635/chto-takoe-tromboz-prichinyi-simptomyi-diagnostika-lechenie-profilaktika, http://www.sweli.ru/beremennost/beremennost/zdorove/patologiya-obuslovlennaya-narusheniem-plodovo-platsentarnogo-krovoobrascheniya.html, http://studopedia.ru/4_51392_patogeneticheskie-i-patomorfologicheskie-izmeneniya-otdelnih-organov-i-sistem-pri-gestoze.html

