Послеоперационный тромбоз легочной артерии
Тромбоэмболия легочной артерии (ТЭЛА) — причины, диагностика, лечение
Понятие тромбоэмболии легочной артерии
Частота развития и смертность от тромбоэмболии легочной артерии
Сегодня тромбоэмболия легочной артерии считается осложнением некоторых соматических заболеваний, послеоперационных и послеродовых состояний. Смертность от данного тяжелейшего осложнения очень высока, и занимает третье место среди самых частых причин летального исхода среди населения, уступая первые две позиции сердечно-сосудистым и онкологическим патологиям.
В настоящее время участились случаи развития тромбоэмболии легочной артерии в следующих случаях:
- на фоне тяжелой патологии;
- в результате проведения сложного оперативного вмешательства;
- после полученной травмы.
Тромбоэмболия легочной артерии представляет собой патологию с крайне тяжелым течением, большим количеством разнородных симптомов, высоким риском смерти больного, а также с затрудненной своевременной диагностикой. Данные аутопсии (посмертного вскрытия) показали, что тромбоэмболия легочной артерии не была своевременно диагностирована у 50-80% людей, умерших по данной причине. Поскольку тромбоэмболия легочной артерии протекает стремительно, становится понятной важность быстрой и правильной диагностики и, как следствие, проведение адекватного лечения, способного спасти жизнь человека. Если тромбоэмболия легочной артерии не была диагностирована, смертность вследствие отсутствия адекватной терапии составляет около 40-50% больных. Смертность среди больных тромбоэмболией легочной артерии, получающих адекватное лечение вовремя, составляет только 10%.
Причины развития тромбоэмболии легочной артерии
Общая причина всех вариантов и типов тромбоэмболии легочной артерии – это образование тромбов в сосудах различной локализации и размера. Такие тромбы впоследствии отрываются и заносятся в легочные артерии, закупоривая их, и прекращая поступление крови дальше этого участка.
Самое распространенное заболевание, приводящее к ТЭЛА — это тромбоз глубоких вен ног. Тромбоз вен ног встречается довольно часто, а отсутствие адекватного лечения и корректной диагностики данного патологического состояния значительно увеличивает риск развития ТЭЛА. Так, ТЭЛА развивается у 40-50% больных с тромбозами бедренных вен. Любое оперативное вмешательство также может осложниться развитием ТЭЛА.
Факторы риска развития тромбоэмболии легочной артерии
Классификация тромбоэмболий легочной артерии
 Тромбоэмболия легочных артерий имеет множество вариантов течения, проявлений, выраженности симптомов и т.д. Поэтому классификация данной патологии осуществляется на основании различных факторов:
Тромбоэмболия легочных артерий имеет множество вариантов течения, проявлений, выраженности симптомов и т.д. Поэтому классификация данной патологии осуществляется на основании различных факторов:
- место закупорки сосуда;
- величина закупоренного сосуда;
- объем легочных артерий, кровоснабжение которых прекратилось в результате эмболии;
- протекание патологического состояния;
- наиболее выраженные симптомы.
Современная классификация тромбоэмболий легочной артерии включает в себя все вышеперечисленные показатели, которые определяют ее степень тяжести, а также принципы и тактику необходимой терапии. В первую очередь течение ТЭЛА может быть острым, хроническим и рецидивирующим. Согласно объему пораженных сосудов, ТЭЛА подразделяется на массивную и не массивную.
Классификация тромбоэмболии легочной артерии в зависимости от локализации тромба основана на уровне поражаемых артерий, и содержит три основных типа:
1. Эмболия на уровне сегментарных артерий.
2. Эмболия на уровне долевых и промежуточных артерий.
3. Эмболия на уровне главных легочных артерий и легочного ствола.
Распространено деление ТЭЛА, согласно уровню локализации в упрощенном виде, на закупорку мелких или крупных ветвей легочной артерии.
Также, в зависимости от локализации тромба, выделяют стороны поражения:
- правая;
- левая;
- с обеих сторон.
В зависимости от особенностей клиники (симптомов), тромбоэмболии легочной артерии подразделяются на три вида:
I. Инфарктная пневмония – представляет собой тромбоэмболию мелких ветвей легочной артерии. Проявляется одышкой, усиливающейся в вертикальном положении, кровохарканьем, высокой частотой сердечных сокращений, а также болями в груди.
II. Острое легочное сердце – представляет собой тромбоэмболию крупных ветвей легочной артерии. Проявляется одышкой, низким давлением, кардиогенным шоком, болями стенокардического характера.
III. Немотивированная одышка – представляет собой рецидивирующую ТЭЛА мелких ветвей. Проявляется одышкой, симптомами хронического легочного сердца.
Степени тяжести тромбоэмболии легочной артерии
Степени нарушения кровоснабжения легких при тромбоэмболии легочной
артерии
Степени нарушения кровотока в зависимости от значений желудочкового давления в сердце и легочном стволе представлены в таблице.
Симптомы различных видов тромбоэмболий легочной артерии
Чтобы вовремя поставить диагноз тромбоэмболии легочной артерии, необходимо четко представлять себе симптомы заболевания, а также быть настороженным в отношении развития данной патологии. Клиническая картина тромбоэмболий легочной артерии весьма разнообразна, поскольку определяется степенью тяжести заболевания, скоростью развития необратимых изменений в легких, а также признаками основного заболевания, приведшего к развитию данного осложнения.
Общие для всех вариантов тромбоэмболий легочной артерии признаки (обязательные):
- одышка, развивающаяся внезапно, по непонятной причине;
- увеличение числа сердечных сокращений более 100 в минуту;
- бледность кожи с серым оттенком;
- боли, локализованные в различных отделах грудной клетки;
- нарушение перистальтики кишечника;
- раздражение брюшины (напряженная брюшная стенка, боль при ощупывании живота);
- резкое кровенаполнение вен шеи и солнечного сплетения с выбуханием, пульсация аорты;
- шум в сердце;
- сильно пониженное артериальное давление.
Данные признаки всегда обнаруживаются при тромбоэмболии легочной артерии, однако ни один из них не является специфическим.
Могут развиваться следующие симптомы (необязательные):
- кровохарканье;
- лихорадка;
- боль в грудной клетке;
- жидкость в грудной полости;
- обморок;
- рвота;
- коматозное состояние;
- судорожная активность.
Характеристика симптомов тромбоэмболии легочной артерии
 Рассмотрим особенности данных симптомов (обязательных и необязательных) более подробно. Одышка развивается внезапно, без каких-либо предварительных признаков, причем явные причины появления тревожного симптома отсутствуют. Одышка возникает на вдохе, звучит тихо, с шелестящим оттенком, причем присутствует постоянно. Помимо одышки тромбоэмболию легочной артерии постоянно сопровождает увеличение частоты сердечных сокращений от 100 ударов в минуту и выше. Артериальное давление сильно падает, причем степень уменьшения обратнопропорциональна степени тяжести заболевания. То есть, чем ниже артериальное давление, тем массивнее патологические изменения, вызванные тромбоэмболией легочной артерии.
Рассмотрим особенности данных симптомов (обязательных и необязательных) более подробно. Одышка развивается внезапно, без каких-либо предварительных признаков, причем явные причины появления тревожного симптома отсутствуют. Одышка возникает на вдохе, звучит тихо, с шелестящим оттенком, причем присутствует постоянно. Помимо одышки тромбоэмболию легочной артерии постоянно сопровождает увеличение частоты сердечных сокращений от 100 ударов в минуту и выше. Артериальное давление сильно падает, причем степень уменьшения обратнопропорциональна степени тяжести заболевания. То есть, чем ниже артериальное давление, тем массивнее патологические изменения, вызванные тромбоэмболией легочной артерии.
Болевые ощущения характеризуются значительной полиморфностью, и зависят от степени тяжести тромбоэмболии, объема пораженных сосудов и степени общепатологических нарушений в организме. Например, закупорка ствола легочной артерии при ТЭЛА повлечет за собой развитие болей за грудиной, которые имеют острый, разрывающий характер. Такое проявление болевого синдрома определяется сдавлением нервов в стенке закупоренного сосуда. Другой вариант болей при тромбоэмболии легочной артерии – подобные стенокардическим, когда развивается сдавливающие, разлитые боли в области сердца, которые могут иррадиировать в руку, лопатку и т.д. При развитии осложнения ТЭЛА в виде инфаркта легкого, боль локализуется во всей грудной клетке, причем усиливается при совершении движений (чихание, кашель, глубокое дыхание). Реже боль при тромбоэмболии локализована справа под ребрами, в области печени.
Недостаточность кровообращения, развивающаяся при тромбоэмболии, может спровоцировать развитие мучительной икоты, пареза кишечника, напряжение передней стенки живота, а также выбухание крупных поверхностных вен большого круга кровообращения (шеи, ног и т.д.). Кожа приобретает бледный цвет, причем может развиваться серый или пепельный отлив, посинение губ присоединяется реже (в основном при массивной тромбоэмболии легочной артерии).
В некоторых случаях можно выслушать сердечный шум в систолу, а также выявить галопирующую аритмию. При развитии инфаркта легкого, как осложнения ТЭЛА, может наблюдаться кровохарканье примерно у 1/3 – 1/2 больных, в сочетании с резкой болезненностью в груди и высокой температурой. Температура держится от нескольких суток до полутора недель.
Тяжелая степень тромбоэмболии легочной артерии (массивная) сопровождается нарушения мозгового кровообращения с симптомами центрального генеза – обмороками, головокружениями, судорогами, икотой или коматозным состоянием.
В некоторых случаях к нарушениям, вызванным тромбоэмболией легочной артерии, присоединяются симптомы острой почечной недостаточности.
Описанные выше симптомы не являются специфичными именно для тромбоэмболии легочной артерии, поэтому для постановки правильного диагноза важно собрать всю историю болезни, обратив особое внимание на наличие патологий, ведущих к тромбозам сосудов. Однако тромбоэмболия легочной артерии обязательно сопровождается развитием одышки, увеличением частоты сердечных сокращений (тахикардия), учащением дыхания, болями в области груди. Если эти четыре симптома отсутствуют, то у человека не тромбоэмболия легочной артерии. Все остальные симптомы необходимо рассматривать в совокупности, учитывая наличие тромбоза глубоких вен или перенесенного инфаркта, которые должны поставить врача и близких родственников больного в позицию настороженности относительно высокого риска развития тромбоэмболии легочной артерии.
Осложнения тромбоэмболии легочной артерии
Основные осложнения тромбоэмболии легочной артерии следующие:
- инфаркт легкого;
- парадоксальная эмболия сосудов большого круга;
- хроническое повышение давления в сосудах легких.
Следует помнить, что своевременное и адекватное лечение позволит свести к минимуму риск развития осложнений.
Тромбоэмболия легочной артерии вызывает серьезные патологические изменения, приводящие к инвалидизации и серьезным нарушениям в функционировании органов и систем.
Основные патологии, развивающиеся вследствие тромбоэмболии легочной артерии:
- инфаркт легкого;
- плеврит;
- пневмония;
- абсцесс легкого;
- эмпиема;
- пневмоторакс;
- острая почечная недостаточность.
Закупорка крупных сосудов легких (сегментарных и долевых) в результате развития ТЭЛА часто приводит к инфаркту легкого. В среднем инфаркт легкого развивается в течение 2-3 суток от момента закупорки сосуда тромбом.
Инфаркт легкого осложняет ТЭЛА при сочетании нескольких факторов:
- закупорка сосуда тромбом;
- уменьшение кровоснабжения участка легкого вследствие снижения такового в бронхиальном дереве;
- нарушения нормального прохождения струи воздуха по бронхам;
- наличие сердечнососудистой патологии (сердечная недостаточность, стеноз митрального клапана);
- наличие хронического обструктивного заболевания легких (ХОБЛ).
Типичные симптомы данного осложнения тромбоэмболии легочной артерии следующие:
- острая боль в груди;
- кровохарканье;
- одышка;
- увеличение частоты сердечных сокращений;
- хрустящий звук при дыхании (крепитация);
- хрипы влажные над пораженной областью легкого;
- лихорадка.
Боль и крепитация развиваются вследствие пропотевания жидкости из легких, причем данные явления становятся более выраженными при совершении движений (кашель, глубокий вдох или выдох). Жидкость постепенно рассасывается, при этом боль и крепитация уменьшаются. Однако возможно развитие иной ситуации: длительное нахождение жидкости в грудной полости приводит к воспалению диафрагмы, и тогда присоединяется острая боль в животе.
Плеврит (воспаление плевры) является осложнением инфаркта легкого, который обусловлен пропотеванием патологической жидкости из пораженного участка органа. Количество пропотеваемой жидкости обычно небольшое, однако достаточное, чтобы вовлечь в воспалительный процесс плевру.
В легком в области развития инфаркта пораженные ткани подвергается распаду с образованием гнойника (абсцесса), эволюционирующего в большую каверну (полость) или эмпиему плевры. Такой гнойник может вскрываться, а его содержимое, состоящее из продуктов распада тканей, попадает в плевральную полость или в просвет бронха, через который и удаляется наружу. Если тромбоэмболии легочной артерии предшествовало наличие хронической инфекции бронхов или легких, площадь поражения вследствие инфаркта будет большей.
Пневмоторакс, эмпиема плевры или абсцесс развиваются достаточно редко после инфаркта легкого, вызванного ТЭЛА.
Патогенез тромбоэмболии легочной артерии
 Вся совокупность процессов, протекающих при закупорке сосуда тромбом, направление их развития, а также возможные исходы, в том числе осложнения, называется патогенезом. Рассмотрим подробнее патогенез тромбоэмболии легочной артерии.
Вся совокупность процессов, протекающих при закупорке сосуда тромбом, направление их развития, а также возможные исходы, в том числе осложнения, называется патогенезом. Рассмотрим подробнее патогенез тромбоэмболии легочной артерии.
Закупорка сосудов легкого приводит к развитию различных дыхательных нарушений и патологии кровообращения. Прекращение кровоснабжения участка легкого возникает из-за закупорки сосуда. В результате закупорки тромбом кровь не может проходить дальше этого участка сосуда. Поэтому все легкое, которое осталось без кровоснабжения, образует так называемое «мертвое пространство». Вся площадь «мертвого пространства» легкого спадается, а просвет соответствующих бронхов сильно суживается. Вынужденная дисфункция с нарушением нормального питания дыхательных органов усугубляется уменьшением синтеза специального вещества – сурфактанта, которое поддерживает альвеолы легкого в неспадающемся состоянии. Нарушение вентиляции, питания, и малое количество сурфактанта – все эти факторы являются ключевыми в развитии ателектаза легкого, который может полностью сформироваться в течение 1-2 суток после тромбоэмболии легочной артерии.
Закупорка легочной артерии также существенно сокращает площадь нормальных, активно функционирующих сосудов. Причем мелкие тромбы закупоривают мелкие сосуды, а большие – крупные ветви легочной артерии. Данное явление приводит к повышению рабочего давления в малом круге, а также к развитию сердечной недостаточности по типу легочного сердца.
Часто к непосредственным последствиям закупорки сосудов присоединяются эффекты рефлекторных и нейрогуморальных механизмов регуляции. Весь комплекс факторов в совокупности приводит к развитию тяжелых сердечнососудистых нарушений, которые не соответствуют объему пораженных сосудов. Данные рефлекторные и гуморальные механизмы саморегуляции включают в себя, в первую очередь, резкое сужение сосудов под действием биологически активных веществ (серотонина, тромбоксана, гистамина).
Тромбообразование в венах ног развивается на основании наличия трех основных факторов, объединённых в комплекс под названием «триада Вирхова».
«Триада Вирхова» включает в себя:
- участок поврежденной внутренней стенки сосуда;
- снижение скорости кровотока в венах;
- синдром повышенного свертывания крови.
Данные составляющие приводят к избыточному образованию тромбов, способных приводить к тромбоэмболии легочной артерии. Наибольшую опасность представляют тромбы, которые плохо прикреплены к стенке сосуда, то есть флоттирующие.
Достаточно «свежие» тромбы в легочных сосудах могут быть подвергнуты растворению, причем с небольшими усилиями. Такое растворение тромба (лизирование), как правило, начинается с момента его фиксации в сосуде с закупоркой последнего, а протекает данный процесс в течение полутора-двух недель. По мере рассасывания тромба и восстановления нормального кровоснабжения участка легкого, орган восстанавливается. То есть, возможно полное выздоровление с восстановлением функций дыхательного органа после перенесенной тромбоэмболии легочной артерии.
Рецидивирующая ТЭЛА – закупорка мелких ветвей легочной артерии.
К сожалению, тромбоэмболия легочной артерии может повторяться несколько раз в течение жизни. Такие повторяющиеся эпизоды данного патологического состояния называются рецидивирующая тромбоэмболия легочной артерии. Рецидивам ТЭЛА подвержены 10-30% больных, которые уже страдали данной патологией. Обычно один человек может переносить различное количество эпизодов ТЭЛА, варьирующее от 2 до 20. Большое количество перенесенных эпизодов ТЭЛА обычно представлено закупоркой мелких ветвей легочной артерии. Таким образом, рецидивирующая форма течения ТЭЛА представляет собой морфологически закупорку именно мелких ветвей легочной артерии. Такие многочисленные эпизоды закупорки мелких сосудов обычно приводят впоследствии к эмболизации крупных ветвей легочной артерии, что формирует массивную ТЭЛА.
Развитию рецидивирующей ТЭЛА способствует наличие хронических заболеваний сердечнососудистой и дыхательной систем, а также онкологических патологий и оперативных вмешательств на органах живота. Рецидивирующая ТЭЛА обычно не имеет четких клинических признаков, что обуславливает ее стертое течение. Поэтому данное состояние редко верно диагностируется, поскольку в большинстве случаев невыраженные признаки принимают за симптомы других заболеваний. Таким образом, рецидивирующая тромбоэмболия легочной артерии трудно диагностируется.
Наиболее часто рецидивирующая тромбоэмболия легочной артерии маскируется под ряд иных заболеваний. Обычно данная патология выражается в следующих состояниях:
- рецидивирующие пневмонии, возникающие по неустановленной причине;
- плевриты, протекающие в течение нескольких суток;
- обморочные состояния;
- сердечнососудистый коллапс;
- приступы удушья;
- увеличение частоты сердечных сокращений;
- затрудненное дыхание;
- повышенная температура, которая не снимается антибактериальными препаратами;
- сердечная недостаточность на фоне отсутствия хронических заболеваний сердца или легких.
Рецидивирующая тромбоэмболия легочной артерии приводит к развитию следующих осложнений:
- пневмосклероз (замещение легочной ткани на соединительную);
- эмфизема легких;
- повышение давления в малом круге кровообращения (гипертензия легких);
- сердечная недостаточность.
Рецидивирующая тромбоэмболия легочной артерии опасна тем, что очередной эпизод может пройти с внезапным летальным исходом.
Диагностика тромбоэмболии легочной артерии
 Диагностика тромбоэмболии легочной артерии достаточно затруднительна. Чтобы заподозрить именно данное заболевание, следует иметь в виду возможность его развития. Поэтому всегда следует обращать внимание на факторы риска, предрасполагающие к развитию ТЭЛА. Подробный расспрос пациента представляет собой жизненно важную необходимость, поскольку указание на наличие инфарктов, операций или тромбозов, поможет правильно определить причину ТЭЛА и область, из которой был принесен тромб, закупоривший легочной сосуд.
Диагностика тромбоэмболии легочной артерии достаточно затруднительна. Чтобы заподозрить именно данное заболевание, следует иметь в виду возможность его развития. Поэтому всегда следует обращать внимание на факторы риска, предрасполагающие к развитию ТЭЛА. Подробный расспрос пациента представляет собой жизненно важную необходимость, поскольку указание на наличие инфарктов, операций или тромбозов, поможет правильно определить причину ТЭЛА и область, из которой был принесен тромб, закупоривший легочной сосуд.
Все остальные обследования, проводимые для выявления или исключения ТЭЛА, делят на две категории:
- обязательные, которые назначают всем пациентам с предположительным диагнозом ТЭЛА для его подтверждения (ЭКГ, рентген, эхокардиография, сцинтиграфия легких, УЗИ вен ног);
- дополнительные, которые проводятся в случае необходимости (ангиопульмонография, илеокаваграфия, давление в желудочках, предсердиях и легочной артерии).
Рассмотрим ценность и информативность различных диагностических методов для выявления ТЭЛА.
Среди лабораторных показателей, при ТЭЛА изменяются значения следующих:
- увеличение концентрации билирубина;
- увеличение общего количества лейкоцитов (лейкоцитоз);
- увеличение скорости оседания эритроцитов (СОЭ);
- увеличение концентрации продуктов деградации фибриногена в плазме крови (в основном D-димеров).
В диагностике тромбоэмболии нужно учитывать развитие различных рентгенологических синдромов, отражающих поражение сосудов определенного уровня. Частота некоторых рентгенологических признаков в зависимости от разнообразных уровней закупорки легочных сосудов при ТЭЛА представлена в таблице.
Профилактика, диагностика и лечение послеоперационной тромбоэмболии легочной артерии
Для цитирования: Карелов А.Е., Хведелидзе И.А. Профилактика, диагностика и лечение послеоперационной тромбоэмболии легочной артерии // РМЖ. 2013. №2. С. 56
Реферат. Профилактика, диагностика и лечение послеоперационной тромбоэмболии легочной артерии представляют собой довольно сложную задачу. Это обусловлено неспецифичностью клинической картины, необходимостью использования сложного дорогостоящего оборудования и большим разнообразием подходов к выбору схемы медикаментозного лечения. Появление новых препаратов в арсенале врача требует осторожного отношения к их назначению и убедительных доказательств их эффективности. Главную роль в настоящее время играют четкое выполнение выбранного алгоритма профилактики, диагностики и лечения этого состояния, а также возможности стационаров и предпочтения лечащих врачей.
 Ключевые слова: послеоперационная ТЭЛА, гепаринопрофилактика, бемипарин.
Ключевые слова: послеоперационная ТЭЛА, гепаринопрофилактика, бемипарин.
Тромбоэмболия легочной артерии (ТЭЛА) является одной из довольно частых и грозных неотложных ситуаций, в т.ч. в послеоперационном периоде. Причина ТЭЛА – это окклюзия ствола или мелких ветвей артерий малого круга кровообращения тромбоэмболами с развитием правожелудочковой, а затем и бивентрикулярной сердечной недостаточности.
В структуре летальности от сердечно-сосудистых заболеваний ТЭЛА занимает третье место после инфаркта миокарда и инсульта. В экономически развитых странах 0,1% населения ежегодно погибают от данной патологии [1, 3, 9]. Дать точную оценку частоте послеоперационной ТЭЛА не представляется возможным, поскольку часто это состояние протекает бессимптомно.
При жизни диагноз ТЭЛА устанавливается менее чем в 70% наблюдений. Летальность среди пациентов без патогенетической терапии, по данным различных авторов, составляет 40% и более, при массивной ТЭЛА достигает 70%, а при своевременно начатой терапии колеблется от 2 до 8% [1, 9]. По данным ряда авторов, ТЭЛА является причиной 5% летальных исходов после общехирургических и 23,7% – после ортопедических операций. Легочная эмболия занимает одно из ведущих мест в акушерской практике: смертность от этого осложнения колеблется от 1,5 до 2,7% на 10 тыс. родов, а в структуре материнской смертности составляет 2,8–9,2% [2].
В европейских странах, в частности во Франции, частота ТЭЛА составляет до 100 тыс. случаев в год, в Англии и Шотландии с ТЭЛА госпитализируются 65 тыс., а в Италии – 60 тыс. пациентов ежегодно [8]. В США в год выявляют до 150 тыс. больных, переносящих ТЭЛА как осложнение различных заболеваний. Среди госпитализированных пациентов 70% приходится на долю терапевтических больных [8]. По данным Фрамингемского исследования, смерть от ТЭЛА составляет 15,6% от всей внутригоспитальной летальности, причем на хирургических больных приходится 18% случаев, а 82% составили больные с терапевтической патологией [1, 9].
Следует понимать, что источник тромба, который достигает малого круга кровообращения, главным образом находится в сосудах бассейна нижней полой вены, а именно – в венах нижних конечностей и малого таза. Чаще всего первичный тромб находится в илеокавальных сегментах или проксимальных отделах вен нижних конечностей (подколенно-бедренном сегменте). Венозный тромбоз с локализацией в дистальных отделах глубоких вен нижних конечностей (голени) осложняется ТЭЛА в 1–5% случаев. В последнее время появились сообщения об учащении случаев ТЭЛА из бассейна верхней полой вены (до 3,5%) в результате постановки венозных катетеров в отделениях реанимации и блоках интенсивной терапии [1, 9].
Наиболее опасными для развития ТЭЛА являются «флотирующие тромбы», имеющие точку фиксации в дистальном отделе венозного русла; остальная их часть расположена свободно и на всем протяжении не связана со стенками вены, причем их протяженность может колебаться от 5 до 20 см. «Флотирующий тромб» обычно формируется в венах меньшего калибра, и процесс тромбообразования распространяется проксимально в более крупные: из глубоких вен голени – в подколенную вену, затем в глубокую и общую бедренную артерию, из внутренней – в общую подвздошную, из общей подвздошной – в нижнюю полую вену [1].
Размеры тромбоэмболов определяют их локализацию в сосудах легочной артерии, обычно они фиксируются в местах деления сосудов легкого. По данным различных авторов, эмболизация ствола и главных ветвей легочной артерии имеет место в 50%, долевых и сегментарных – в 22%, мелких ветвей – в 30% случаев. Одновременное поражение артерий обоих легких достигает 65% от всех случаев ТЭЛА, в 20% – поражается только правое, в 10% – только левое легкое, нижние доли поражаются в 4 раза чаще, чем верхние [9].
Факторы риска венозного тромбоэмболизма (ТЭЛА в частности) следующие: пожилой возраст, длительная обездвиженность (вследствие пареза конечностей, после травм, в послеоперационном периоде, при частых и продолжительных перелетах в самолетах или поездках в автомобилях и т.д.), онкологические заболевания, травмы (особенно переломы крупных костей), хирургические вмешательства и внутрисосудистые инвазивные манипуляции (подключичный катетер и др.), прием некоторых лекарственных препаратов (заместительная гормональная терапия, использование оральных контрацептивов, химиотерапия), хроническая сердечная или дыхательная недостаточность, беременность и послеродовый период, тромбофилия. Имеются данные о том, что ТЭЛА ассоциируется также с такими проблемами, как ожирение, метаболический синдром, артериальная гипертензия, курение, сердечно-сосудистые события (инфаркт миокарда, инсульт). Так, тромбоэмболические осложнения, по данным разных авторов, встречаются у 30–60% больных с инсультами, обусловившими паралич нижних конечностей, у 5–35% пациентов после перенесенного инфаркта миокарда, более чем у 12% лиц с застойной сердечной недостаточностью. Серьезным фактором риска является наличие заболеваний вен нижних конечностей в анамнезе, особенно тромбоз глубоких вен. Частота ТЭЛА увеличивается с возрастом: средний возраст больных ТЭЛА составляет 62 года, при этом большинство (не менее 65%) пациентов старше 60 лет, а у больных старше 80 лет ТЭЛА встречается в 8 раз чаще, чем у лиц моложе 50 лет [1, 9].
Тромбы из вен нижних конечностей и таза с током крови попадают в правое предсердие, затем в правый желудочек, где происходит их фрагментация. Из правого желудочка тромбы попадают в малый круг кровообращения. Массивная легочная эмболия сопровождается повышением давления в легочной артерии, а это приводит к увеличению общего сосудистого сопротивления в легких. Возникают перегрузка правого желудочка, падение сердечного выброса и развитие острой сердечно-сосудистой недостаточности.
Диагностика послеоперационной ТЭЛА представляет собой нелегкую задачу. Симптомы ТЭЛА не имеют четкой специфичности, клиническая картина ассоциируется с обострением таких заболеваний, как ишемическая болезнь сердца, хроническая сердечная недостаточность, заболевания легких или является одним из осложнений онкологических заболеваний, травм, обширных хирургических вмешательств.
Наиболее характерными симптомами ТЭЛА являются «тихая» одышка инспираторного типа с частотой до 24 уд./мин. и выше, тахикардия более 90 уд./мин., бледность с пепельным оттенком кожных покровов. При массивной ТЭЛА имеет место (в 20% случаев) выраженный цианоз лица, шеи и верхней половины туловища. Загрудинные боли при эмболии основного ствола легочной артерии носят раздирающий характер (раздражение афферентных окончаний, заложенных в стенке артерии). Резкое уменьшение коронарного кровотока вследствие снижения ударного и минутного объемов сердца может вызвать стенокардитические боли. Острое набухание печени при правожелудочковой недостаточности обусловливает сильные боли в правом подреберье, часто сочетающиеся с симптомами раздражения брюшины и парезом кишечника. Развитие острого легочного сердца проявляется набуханием шейных вен, патологической пульсацией в эпигастрии. На аорте выслушивается акцент II тона, под мечевидным отростком – систолический шум, в точке Боткина – ритм галопа. Центральное венозное давление может быть значительно повышено. Выраженная артериальная гипотензия, вплоть до развития шока, указывает на массивную ТЭЛА. Кровохарканье, отмечаемое у 30% больных, обусловлено развитием инфаркта легкого [1, 7, 9].
Методы инструментальной диагностики требуют проведения специальных процедур, имеющих ограниченное распространение. К ним относятся, прежде всего, ангиография малого круга кровообращения («золотой стандарт» диагностики ТЭЛА) и сцинтиграфия легких.
При ангиографии прямыми признаками ТЭЛА являются дефект наполнения в просвете сосуда и «ампутация» (т. е. обрыв) сосуда, а косвенными – расширение главных легочных артерий, уменьшение числа контрастированных периферических ветвей, деформация легочного рисунка.
Рентгенологические исследования малоинформативны. Наиболее характерными симптомами острого легочного сердца (в 15% случаев) как проявления ТЭЛА являются расширение верхней полой вены и тени сердца вправо, а также набухание конуса легочной артерии, которое проявляется сглаживанием талии сердца и выбуханием второй дуги за левый контур. Может наблюдаться расширение корня легкого (в 4–16% случаев), его «обрубленность» и деформация на стороне поражения. При эмболии в одну из главных ветвей легочной артерии, в долевые или сегментарные ветви при отсутствии фоновой бронхолегочной патологии наблюдается обеднение («просветление») легочного рисунка (симптом Вестермарка). Дисковидные ателектазы, отмечаемые в 3–8% случаев, обычно предшествуют развитию инфаркта легкого и обусловлены обструкцией бронха геморрагическим секретом или увеличенным количеством бронхиальной слизи, а также снижением выработки альвеолярного сурфактанта. Инфаркт легкого развивается на 2–3-и сутки после эмболизации и клинически проявляется болями в грудной клетке при дыхании и кашле, одышкой, тахикардией, крепитацией, влажными хрипами в легких, гипертермией.
В настоящее время алгоритм диагностики ТЭЛА основан преимущественно на использовании компьютерной томографии (КТ) – чувствительного, неинвазивного и относительно доступного метода обследования, однако предварительно необходимо исключить пациентов, которым КТ не потребуется (для больных высокого риска – с помощью эхокардиограммы (ЭхоКГ), для больных невысокого риска – с помощью оценки вероятности ТЭЛА и определения уровня D-димера). КТ на сегодняшний день признана экспертами наиболее приемлемым методом подтверждения наличия тромба в легочных сосудах, рекомендованным для рутинной клинической практики. У больных высокого риска достаточно обычной (однодетекторной) КТ, чтобы подтвердить или исключить ТЭЛА, однако у больных невысокого риска рекомендуется использовать мультидетекторную КТ, которая позволяет более четко визуализировать сегментарные и субсегментарные ветви легочной артерии и достоверно подтвердить или исключить ТЭЛА. Если нет возможности использовать мультидетекторную КТ, у таких пациентов либо устанавливается диагноз ТЭЛА при положительных результатах однодетекторной КТ, либо требуется двойной контроль для исключения ТЭЛА, когда негативные результаты однодетекторной КТ сопоставляются с данными венозной компрессионной ультрасонографии, и если оба метода обследования не обнаружат тромбов, только тогда диагноз ТЭЛА можно снять.
На ЭКГ острая перегрузка правого желудочка вследствие высокого давления в малом круге кровообращения приводит к появлению зубцов SI и QIII (так называемый тип SI-QIII). В отведении V1, V2 возрастает амплитуда зубца R. Возможно появление зубца S в отведениях V4–V6. Сегмент ST дискордантно смещается книзу в отведениях I, II, aVL и кверху – в отведениях III, aVF, иногда V1 и V2. Одновременно появляется выраженный отрицательный зубец Т в отведениях V1–V4, а также в II и aVF. Перегрузка правого предсердия может привести к появлению высокого зубца Р в отверстиях II и III (P-pulmonale). Признаки острой перегрузки правого желудочка чаще наблюдаются при эмболии ствола и главных ветвей легочной артерии, чем при поражении долевых и сегментарных ветвей.
С помощью ЭхоКГ можно проводить оценку параметров гемодинамики и структурного состояния миокарда, степени выраженности гипертензии малого круга кровообращения, наличия тромботических масс в полостях сердца, исключить пороки сердца и оценить результаты лечения. Наиболее часто обнаруживают дилатацию правых отделов сердца и легочной артерии, парадоксальное движение межжелудочковой перегородки, трикуспидальную регургитацию, отсутствие коллабирования нижней полой вены, открытое овальное окно, что встречается редко.
В результатах лабораторных тестов высокий титр D–димера может свидетельствовать о наличии у пациента венозного тромбоза и ТЭЛА лишь в том случае, если исключены другие состояния, протекающие с образованием фибрина, например очаги некроза и воспаления (при заболеваниях органов брюшной и грудной полости, абсцессах, после недавно перенесенных оперативных вмешательств и травм). В то же время, этот показатель может быть использован в качестве метода скрининга в связи с высокой чувствительностью. Однако показателей, однозначно указывающих на возникновение ТЭЛА, не существует.
Вероятность ТЭЛА предварительно можно оценить по шкале M.W. Roges и P.S. Wells (2001) [7]:
• клинические симптомы тромбоза глубоких вен нижних конечностей – 3 балла;
• при проведении дифференциальной диагностики ТЭЛА более вероятна, чем другие заболевания – 3 балла;
• тахикардия >100 уд./мин. – 1,5 балла;
• иммобилизация или хирургическое вмешательство на протяжении последних 3 дней – 1,5 балла;
• тромбоз глубоких вен нижних конечностей или ТЭЛА в анамнезе – 1,5 балла;
• кровохарканье – 1 балл;
• онкологическая патология в настоящее время или давностью до 6 мес. – 1 балл.
Если сумма не превышает 2 баллов, вероятность ТЭЛА низкая; при сумме баллов 2–6 – умеренная; более 6 баллов – высокая.
Кроме того, в последние годы в Европе нередко используется так называемая Женевская шкала [4]:
• тахикардия ≥95 уд./мин. – 5 баллов;
• тахикардия 75–94 уд./мин. – 3 балла;
• клинические признаки тромбоза глубоких вен нижних конечностей (боль при пальпации вены + отек одной конечности) – 4 балла;
• подозрение на тромбоз глубоких вен нижних конечностей (боль в одной конечности) – 3 балла;
• подтвержденные тромбоз глубоких вен нижних конечностей или ТЭЛА в анамнезе – 3 балла;
• хирургическое вмешательство или перелом на протяжении последнего месяца – 2 балла;
• кровохарканье – 2 балла;
• онкологическая патология – 2 балла;
• возраст старше 65 лет – 1 балл.
Если сумма не превышает 3 баллов, вероятность ТЭЛА низкая; при сумме баллов 4–10 – умеренная; ≥11 баллов – высокая.
Основными направлениями лечения ТЭЛА являются гемодинамическая и респираторная поддержка, реперфузия (тромболизис или хирургическое удаление эмболов из легочных артерий), антикоагулянтная терапия. При этом стратегия лечения существенно зависит от степени риска [1, 7].
Антикоагулянтную терапию следует начинать немедленно у пациентов с высокой или средней вероятностью ТЭЛА еще в процессе диагностики, не дожидаясь окончательного подтверждения диагноза. Учитывая высокий риск быстрого развития угрожающих жизни осложнений, необходимость агрессивной терапии и тщательного ее клинико-лабораторного контроля, целесообразно все лечебно-диагностические мероприятия у больных с подозрением на острую ТЭЛА проводить в отделениях интенсивной терапии.
Лечение ТЭЛА у пациентов высокого риска:
1. Начинают лечение с быстродействующих прямых антикоагулянтов с последующим, насколько возможно ранним переходом на непрямые.
2. Для профилактики дальнейшего прогрессирования правожелудочковой недостаточности необходимо устранить системную артериальную гипотензию. С этой целью рекомендуется применять вазопрессоры. У пациентов с низким сердечным выбросом и нормальным АД могут быть использованы инотропы, такие как добутамин и дофамин.
3. Не рекомендуется агрессивная инфузионная терапия.
4. Пациентам с гипоксемией необходимо проведение оксигенотерапии.
5. У пациентов высокого риска с ТЭЛА, сопровождающейся кардиогенным шоком и/или артериальной гипотензией, показана тромболитическая терапия.
6. Если тромболизис абсолютно противопоказан или оказался неэффективным, альтернативными методами реперфузии являются хирургическая эмболэктомия и в качестве альтернативного метода реперфузии может рассматриваться также чрескожная катетерная эмболэктомия или фрагментация тромба.
Лечение ТЭЛА у пациентов невысокого (умеренного или низкого) риска:
1. Антикоагулянтная терапия.
2. Рутинное использование тромболитической терапии у больных невысокого риска не рекомендовано, но ее целесообразность может быть рассмотрена у некоторых пациентов с умеренным риском.
Тромболизис наиболее эффективен у пациентов, которым реперфузия была проведена в первые 48 ч после начала ТЭЛА, однако тромболитическая терапия может быть успешной и у тех больных, у которых первые симптомы ТЭЛА появились 6–14 дней назад. Тромболитическая терапия не показана у пациентов с низким риском.
Для тромболитической терапии при ТЭЛА в настоящее время одобрено применение трех препаратов [1]:
1. Стрептокиназа либо по обычной схеме – нагрузочная доза 250 тыс. МЕ (в течение 30 мин.), далее 100 тыс. МЕ в час в течение 12–24 ч, либо по ускоренной – 1,5 млн МЕ в течение 2 ч.
2. Урокиназа либо по обычной схеме – нагрузочная доза 4400 МЕ/кг массы тела (в течение 10 мин.), далее 4400 МЕ/кг массы тела в час в течение 12–24 ч либо по ускоренной схеме – 3 млн МЕ в течение 2 ч.
3. Тканевой активатор плазминогена (альтеплаза): 100 мг в течение 2 ч или 0,6 мг/кг массы тела в течение 15 мин. (максимальная доза 50 мг).
В современных условиях особую роль отводят профилактике ТЭЛА, которая, согласно приказу Минздрава РФ от 09.06.2003 № 233 «Об утверждении отраслевого стандарта “Протокол ведения больных. Профилактика тромбоэмболии легочной артерии при хирургических и иных инвазивных вмешательствах”», заключается в следующих мероприятиях:
• Выявление пациентов с высокой степенью риска возникновения ТЭЛА.
• Максимально ранняя активизация больного в послеоперационном периоде: подъем и активная ходьба (однако противопоказана длительная статическая нагрузка в положении стоя, сидя).
• Эластическая компрессия нижних конечностей (бинты эластические или чулки 1 или 2 компрессионного классов). Эластические бинты или чулки используются до операции, во время операции (кроме операций на нижних конечностях) и после операции вплоть до выписки из стационара.
• Перемежающаяся пневмокомпрессия (рекомендована к использованию при противопоказаниях к гепаринопрофилактике).
• Применение лекарственных препаратов.
Алгоритм профилактики прямыми антикоагулянтами заключается в назначении гепарина натрия в суточной дозе 15 000 МЕ, при массе тела ниже 50 кг суточную дозу гепарина снижают до 10 000 МЕ. Гепарин вводят под кожу живота, интервал между инъекциями составляет 8 ч. Продолжительность профилактической гепаринизации – не менее 3 дней. Продолжительное кровотечение служит абсолютным противопоказанием к назначению антикоагулянтов.
Алгоритм профилактики непрямыми коагулянтами включает в себя применение низкомолекулярных гепаринов первого поколения: дальтепарина, надропарина, эноксипарина. Эти препараты удобны тем, что могут быть введены подкожно один раз в сутки в дозах 0,6 мл/сут (0,8 мл/сут при массе тела выше 120 кг), 5000 ед/сут (7500 ед/сут при массе тела свыше 120 кг) или 40 мг/сут (60 мг/сут при массе тела выше 120 кг) соответственно.
Антиагреганты. При уровне тромбоцитов, превышающем норму, показано назначение антиагрегантов: ацетилсалициловая кислота, тиклопидин, клопидрогел в общетерапевтических дозах.
Несмотря на то, что приказ №233 регламентирует использование нефракционированного гепарина и низкомолекулярных гепаринов первого поколения, следует помнить, что в нашем арсенале уже есть препарат низкомолекулярных гепаринов второго поколения. В настоящее время он активно изучается, и количество данных о его клиническом применении ограничено. Тем не менее, уже проведены исследования, характеризующие его эффективность у пациентов после ортопедических, гинекологических и других видов операций.
Бемипарин (Цибор®) – это низкомолекулярный гепарин второго поколения. Он обладает самой низкой молекулярной массой, равной 3600 Да и самым продолжительным периодом полувыведения (5,3 ч). Предварительные результаты недавних исследований позволяют предположить, что низкомолекулярные гепарины, в частности бемипарин, могут использоваться для лечения и профилактики тромбоэмболических осложнений, в т.ч. и вне стационара, у пациентов с нетяжелой ТЭЛА и у больных раком [5].
Такая возможность была исследована в двойном слепом многоцентровом исследовании CANBESURE (n=703) [6]. В это исследование были включены пациенты старше 40 лет, которым было проведено хирургическое вмешательство по поводу ранее диагностированных злокачественных опухолей (первичных или метастатических) желудочно-кишечного тракта, мочевыводящих путей или женской репродуктивной системы. В исследование включались только пациенты с ожидаемой продолжительностью жизни не менее 3 мес., у которых операция проводилась под общим наркозом или спинномозговой анестезией и длилась не менее 30 мин.
Перед рандомизацией все пациенты получали бемипарин подкожно в дозе 3500 МЕ 1 р/сут в течение 8±2 дня (первая доза вводилась через 6 ч после операции). Затем больных случайным образом разделили на группу продолжения тромбопрофилактики бемипарином в том же режиме в течение дополнительных 20±2 дней и группу плацебо-контроля. Через 28 дней после операции проводилась двусторонняя восходящая венография. Отдаленные результаты наблюдали в течение 3 мес.
Главной конечной точкой эффективности служила совокупность симптоматических и бессимптомных тромбозов глубоких вен (ТГВ), нефатальных ТЭЛА, а также случаев смерти от любых причин. Проводился также проспективный учет дополнительной комбинированной конечной точки, включавшей в себя проксимальные ТГВ, симптоматические нефатальные ТЭЛА и случаи смерти по причине ТЭЛА.
Главная конечная точка эффективности была зарегистрирована у 10,1% пациентов группы бемипарина и 13,3% больных в группе плацебо. Хотя различия между группами не достигли статистически достоверного уровня (р=0,263), уровень относительного риска развития ТЭЛА в группе бемипарина оказался ниже на 24,4%.
Частота наступления дополнительной конечной точки оказалась достоверно ниже в группе бемипарина (0,8% против 4,6%, p=0,016), а относительный риск развития ТЭЛА в группе бемипарина оказался ниже на 82,4% по сравнению с группой плацебо.
Риск геморрагических осложнений при продлении тромбопрофилактики бемипарином на 3 нед. достоверно не увеличился. Серьезные кровотечения развились у 0,6% больных группы бемипарина против 0,3% группы плацебо (недостоверные различия, p=0,572).
Результаты исследования CANBESURE позволяют сделать вывод, что продленная до 4 нед. тромбопрофилактика бемипарином в дозе 3500 МЕ/сут после абдоминальных или тазовых операций по удалению злокачественных опухолей достоверно снижает риск развития тяжелых тромбоэмболий без повышения риска геморрагических осложнений, по сравнению со стандартным недельным курсом тромбопрофилактики прямыми антикоагулянтами.
В заключение следует сказать, что послеоперационная ТЭЛА остается актуальной современной проблемой. Несмотря на наличие большого объема литературных данных, выбор схемы лечения и профилактики послеоперационной ТЭЛА ложится на плечи лечащего врача и зависит от обеспеченности лечебного учреждения.
Литература
1. Котельников М.В. Тромбоэмболия легочной артерии (современные подходы к диагностике и лечению). М., 2002.
2. Макаров О.В., Озолиня Л.А., Пархоменко Т.В., Керчелаева С.Б. Профилактика тромбоэмболических осложнений в акушерской практике // Рос. мед. журн. 1998. № 1. С. 28–32.
3. Darryl Y. Sue, M.D. Pulmonary Disease // Frederic S. Dongard (ed.): Current: Critical Care Diagnosis & Treatment. US – a lange medical book. First Edition. P. 496.
4. Le Gal G., Perrier A. Contemporary approach to the diagnosis of non-massive pulmonary embolism // Curr. Opin. Pulm. Med. 2006..Vol. 12(5). P. 291–298.
5. Martanez-Gonzilez J., Vila L., Rodriguez C. Bemiparin: second-generation, low-molecular-weight heparin for treatment and prophylaxis of venous thromboembolism // Expert. Rev. Cardiovasc. Ther. 2008. Vol. 6(6). P. 793–802.
6. Monreal B.M., Vignoli A., Lecumberri V.R. et al. Bemiparin in oncology // Drugs. 2010. Vol. 70 (Suppl. 2). P. 35–42.
7. Rodger M., Wells P.S. Diagnosis of Pulmonary Embolism // Thromb. Res. 2001. Vol. 103. P. 225–238.
8. Sharma G.V.R.K., Schoolman M., Sasahara A.A. Diagnosis and Treatment of Pulmonary Embolism // Melvin M., Sheinman, M.D. (eds.) Cardiac Emergencies. W.B. Saunders Company, 1984. P. 349.
9. Task Force Report. Guidelines on diagnosis and management of acute pulmonary embolism. European Society of Cardiology // Eur. Heart J. 2000. Vol. 21. P. 1301–1336.
Похожие статьи в журнале РМЖ
Реферат. Анемия – одно из наиболее часто возникающих осложнений химиотерапии. У паци.
Кардиолог — сайт о заболеваниях сердца и сосудов

Кардиолог онлайн

Кардиохирург онлайн
- Главная

- Сердечно-сосудистая хирургия

- Операции на сердце

- Хирургическое лечение тромбоэмболии легочной артерии (ТЭЛА)
Хирургическое лечение тромбоэмболии легочной артерии (ТЭЛА)
Тромбоэмболия легочной артерии (ТЭЛА) — третья по частоте после патологии сердца и злокачественных опухолей причина смерти. Приблизительно 75% патологоанатомически доказанных случаев не проявляются клинически.
Dalen выявил, что в Соединенных Штатах легочная эмболия развивается у 630 000 больных ежегодно. Из госпитализированных с ТЭЛА 12-21% пациентов погибают в стационаре и 24-39% умирают в течение 12 месяцев. Таким образом, 36-60% пациентов, которые переживают начальный эпизод, имеют различные клинические проявления постэмболического синдрома. Более 90% клинически диагностированных ТЭЛА связаны с тромбозом глубоких вен нижних конечностей, который у 2/3 больных протекает бессимптомно.
Прогноз для пациентов с легочной гипертензией неблагоприятен, особенно у тех из них, кто не имеет внутрисердечного шунта. Фактически, как только среднее легочное давление у пациентов ТЭЛА достигает 50 мм рт.ст. или выше, 3-летняя смертность приближается к 90%. Варианты хирургического лечения зависят и от первичного процесса болезни и от обратимости легочной гипертонии. Трансплантация легкого — единственный эффективный метод лечения пациентов с легочной гипертонией в терминальной стадии. Вместе с тем, связанные с ней побочные эффекты: более высокая смертность, длительное время ожидания и неудовлетворительный прогноз по сравнению с тромбэндартерэктомией делает трансплантацию проблематичной.
Тромбоз глубоких вен – основная причина ТЭЛА
Тромбоз глубоких вен прежде всего, затрагивает вены нижних конечностей и редко венозную систему в другом месте. Легочная эмболия также может быть следствием тромбоза правого предсердия, желудочка или печеночных вен. При микроскопическом исследовании тромбы выявляются в области клапанов вен. Тромбы состоят из фибрина, тромбоцитов большого эритроцитов.
В 1856 г. Rudolf Virchow предположил, что причины образования тромбов связаны с венозным застоем, повреждением стенки вены и гиперкоагуляцией. Эта триада этиологических факторов остается уместной сегодня и подтверждается растущим количеством современных исследований. Цитокины, интерлeйкин-I и фактор некроза опухоли, производимые макрофагами и другими клетками в различных патологических условиях стимулируют деятельность прокоагулянта эндлотелиальных клеток. Эти процессы могут объединиться с венозным застоем, микроскопическими повреждениями эндотелия, деятельностью прокоагулянтов крови, чтобы стимулировать формирование начального тромба в венозных карманах клапанов глубоких вен нижних конечностей. Некоторые пациенты с тромбозом глубоких вен имеют дефицит естественных антикоагулянтов: антитромбина — естественной плазменной протеазы, которая предотвращает образование тромбина; C-белка — мощного ингибитора V и VII факторов свертывания и S-белка, как кофактора для деятельности антикоагулянтов. У 6-7% населения гомо- и гетерозиготные мутации указанных факторов связаны с венозным тромбозом и легочной эмболией, в отличие от артериальных тромбозов при инфаркте миокарда.
В дополнение к трем классическим факторам риска, описанным выше, уменьшенная фибринолитическая активность крови может также внести свой вклад в развитие тромбоза. Снижение фибринолитической активности может быть следствием уменьшенного производства тканевого активатора профибринолизина (t-Пенсильвания) или увеличения концентрации ингибитора активатора профибринолизина-I. Кроме того, отмечено, что активность фибринолитиков меньше в венах нижних, чем в верхних конечностей, особенно у пожилых пациентов.
Наличие главных факторов риска увеличивает вероятность венозной томбоэмболии. У пациентов с клинически подозреваемым тромбозом глубоких вен — 50% с тремя факторами риска имеют доказанный диагноз тромбоза. С другой стороны, при отсутствии любых факторов риска тромбозы отмечены только в 11% больных.
Предыдущие томбоэмболии, пожилой возраст, хирургические операции на бедре или колене, множественная травма, и злокачественные опухоли – также серьезные факторы риска. У пациентов с венозной томбоэмболией в анамнезе риск развития нового эпизода в течение госпитализации — почти в восемь раз больше чем других больных. У 10% пациентов с первым эпизодом тромбоза глубоких вен или ТЭЛА и до 20% с текущим заболеванием развивается новый эпизод венозной тромбоэмболии в течение 6 месяцев. Больные в 70-80-летнем возрасте в 200 раз чаще страдают ТЭЛА, чем пациенты в возрасте 55 мм рт.ст., окклюзия более 50% артериального русла легких и уровень артериального насыщения О2 2
Результаты
Выживаемость после экстренной легочной тромбоэмболэктомии варьирует в пределах от 40% до 92%. В тех случаях, когда выполнение операции сопровождается проведением закрытого, а в последующем открытого массажа сердца без поддержки экстракорпоральной перфузии, летальность достигает 45-75%. В случаях выполнения операции без остановки сердца летальность колеблется от 8% до 36%. Основными причинами смерти являются ишемическое повреждение мозга, сердечная недостаточность и сепсис. Повторные тромбоэмболии достаточно редки. Около 80% выживших больных в отдаленном послеоперационном периоде имеют нормальное давление в легочной артерии и приемлемую толерантность к физической нагрузке. У 10% в отдаленном послеоперационном периоде сохраняется обструкция около 40-50% легочных сосудов, что значительно снижает функцию легких и толерантность к физической нагрузке.
Хроническая посттромбоэмболическая легочная гипертензия
Хроническая посттромбоэмболическая легочная гипертензия развивается у 0,1-0,5% выживших после тромбоэмболии легочной артерии пациентов.
Патоморфологические изменения
Патоморфологические изменения сводятся к тромбоэмболической окклюзии микрососудистого легочного русла. Легочная биопсия показывает наличие различной степени медиальной гипертрофии и тяжелой эксцентрической энтимальной фиброплазии. Такое эксцентричное развитие фиброзной ткани ассоциируется с плексогемической артериопатией. Появление таких тромботических повреждений приводит к распространению этого процесса от микрососудистого русла к сегментарным и лобулярным артериям чаще, чем развитие эмболии.
Патофизиология
Патофизиология развития легочной гипертензии включает увеличение постнагрузки для правого желудочка вследствие окклюзии легочных артерий и ее ветвей. В основе развития легочной гипертензии лежит снижение комплайнса (податливости) центральных легочных артерий. Комплайнс легочного русла в норме достаточно большой и может увеличиваться в 3-4 раза от состояния покоя. Комплайнс легочного русла кровообращения позволяет в 2-3 раза увеличить объем крови, прежде чем давление в легочной артерии увеличиться вдвое. Тромбоэмболические материалы препятствуют такой нормальной реакции легочного сосудистого русла.
Своевременное хирургическое лечение, освобождающее легочное русло кровообращения от обструктивных материалов позволяет открыть легочные сосуды и вызвать обратное развитие повреждения микроциркуляции.
Диагностика
Диагностика и лечение хронической посттромбоэмболической легочной гипертензии требует специфического подхода, как в плане оценки возможности хирургического вмешательства, так и возможности анестезии и послеоперационного ведения пациентов в отделении интенсивной терапии. При правильном подходе легочная тромбэндартерэктомия может быть осуществлена с приемлемым риском.
Нет никаких абсолютных клинических признаков, характерных для хронической ТЭЛА. Самый общий признак, связанный с легочной гипертензией – одышка. Обмороки или предобморочные состояний — другой общий признак легочной гипертензии. Неопределенные боли груди наблюдаются у 50% пациентов. Периферические отеки появляются при развитии недостаточности ПЖ. Физикальное обследование позволяет выявить яремный венозный пульс. У некоторых пациентов развивается цианоз. Аускультативно над легочной артерией II тон усилен, слышен систолический щелчок изгнания и диастолический шум недостаточности клапана ЛА, а также систолический шум недостаточности трехстворчатого клапана.
Тесты легочной функции показывают минимальные изменения в объеме легких и вентиляции. Пациенты имеют нормальную или немного ограниченную легочную механику. Жизненная емкость легких часто уменьшается и может быть единственным признаком нарушения функции легких. Давление в ЛА увеличено, сердечный выброс снижен. Анализ газов крови выявляют гипоксию (PaO2 53-80 мм рт.ст.), PaCO2 300 ед./сек./см -5 ) и функции газообмена во время отдыха или при физической нагрузке. У больных со II функциональным классом NYHA и меньшим легочным сопротивлением наиболее приемлемо медикаментозное лечение, особенно в случаях, если поражены сегментарные или субсегментарные артерии. Тромбэндартерэктомия из легочной артерии показана также пациентам, которые имеют нормальную или близкую к нормальной легочную гемодинамику в покое, однако при выполнении физической нагрузки давление в легочной артерии значительно возрастает.
Кроме указанных критериев необходимо оценивать:
• Уровень легочной гипертензии. Данные литературы показывают, что успех операции наиболее вероятен при уровне систолического давления в легочном стволе, не превышающем 90-95 мм рт.ст. С другой стороны, вряд ли оправдан риск тяжелого вмешательства у больных при давлении ниже 50 мм рт.ст., поскольку оно не может обусловить быстрого развития правожелудочковой недостаточности.
• Состояние дистального сосудистого русла легких. Основным критерием возможности выполнения тромбэндартерэктомии является локализация окклюзии легочного русла кровообращения. Успех возможен только при локализации тромбов в главной долевой или проксимальных отделах сегментарных артерий. В тех случаях, когда локализация окклюзирующих поражений легочного русла относится ко вторичным или более мелким артериях, то легочная тромбэндартерэктомия из основных главных сосудов не приводит к снижению давления в легочном русле в послеоперационном периоде. Однако в дооперационном периоде не просто решить вопрос о состоянии сегментарных легочных артерий, расположенных дистальнее зоны окклюзии. Частота форм гипертензии, подлежащих хирургическому лечению, оценивается L. Antebi (1962) в 25-30%. По мнению E. Hurwitt и соавт. (1958), она достигает 50%. Последняя цифра перекликается с результатами патологоанатомических исследований S. Orell (1962), показавшими, что в половине случаев постэмболическая окклюзия локализуется в главных легочных артериях.
• Длительность заболевания. Возможности хирургического вмешательства во многом зависят от длительности нахождения тромбов в легочных артериях. V.Dor и соавт. (1981) полагают, что лучшие результаты могут быть получены при выполнении операции в течение 6-8 недель от момента эмболической окклюзии. Существует и противоположная точка зрения, которая заключается в полном игнорировании этого фактора. Вместе с тем, восстановление проходимости главных легочных магистралей не может привести к выздоровлению, так как продолжительное существование высокой гипертензии малого круга кровообращения приводит к необратимым изменениям всей легочной сосудистой системы, паренхимы легких и миокарда. Такие больные являются кандидатами для трансплантации сердечно-легочного комплекса.
Чем меньше времени прошло с момента эмболии, тем операция технически легче выполнима. Из литературы ясно, что в первые недели и даже месяцы с момента тромбоэмболии процесс спонтанного восстановления проходимости легочного сосудистого русла может продолжаться. В более поздние сроки он идет уже за счет механической фрагментации, ретракции тромба и гуморального лизиса, а также благодаря процессу «органической фрагментации», вызванному прорастанием эндотелиоцитов, лизиса вросшими полимофноядерными лейкоцитами и фиброваскулярной организации.
По мнению V. Door и соавт. (1981), больные, у которых по данным ангиографиического и гемодинамического контроля отсутствует адекватное восстановление легочного кровотока в течение 3-4 недель с момента тромбоэмболии, должны быть оперированы. D. Sabiston и соавт. (1977), R.Symbas (1977), считают 3 месяца предельным сроком, после которого спонтанное или под влиянием медикаментозного лечения восстановление проходимости легочного сосудистого русла невозможно. Следует отметить, что быстрое прогрессирование симптомов сердечно-легочной недостаточности может сделать необходимым оперативное вмешательство еще до наступления этого контрольного срока.
Противопоказания к легочной тромбэндартерэктомии
Противопоказанием к выполнению легочной тромбэндартерэктомии является сопутствующее самостоятельное заболевание легких в виде обструктивного бронхита, старческий возраст, тяжелая правожелудочковая недостаточность.
Коронарная ангиография должна быть проведена пациентам с подозрением на ИБС. При необходимости АКШ выполняется одновременно с тромбэндартерэктомией. Имплантация кавафильтров в нижнюю полую вену, как правило, рекомендуется перед выполнением основной операции.
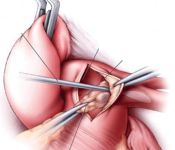
Легочная тромбэндартерэктомия. Техника операции
Оперативное вмешательство при хронических постэмболических поражениях представляет собой технически гораздо более сложную задачу, чем в острой стадии легочной эмболии. Плотное спаяние тромба с артериальной стенкой значительно удлиняет внутрисосудистый этап операции и в большинстве случаев требует обнажения не только легочного ствола, но также главных легочных артерий и их долевых ветвей. Вторым немаловажным фактором является наличие высокой гипертензии малого круга, какой не бывает в острой стадии заболевания. От этих обстоятельств зависят доступ, используемый во время операции, и условия, в которых она проводится.
Первую успешную легочную тромбэндартерэктомию осуществил Allison через стернотомию с использованием умеренной гипотермии. В 1978 г. Cabrol описал 16 больных после тромбэндартерэктомии. 14 больных из этой серии были оперированы через боковую торакотомию и двое через срединную стернотомию без искусственного кровообращения. Из 14 больных, оперированных в условиях искусственного кровообращения, 12 выжили. Эти операции производились с использованием глубокой гипотермии и временной остановки кровообращения, которая в последующем стала стандартной процедурой.
Под седацией мидазоламом проводится канюляция a.radialis, вен шеи и введение катетера Swan-Ganz в легочную артерию для постоянного контроля давления и сердечного выброса в режиме реального времени. Транспищеводная эхокардиография необходима для выявления открытого овального окна, которое может стать причиной парадоксальной эмболии из правых в левые отделы сердца. Операция выполняется под обезболиванием фентанилом, использованием миорелаксантов, для поддержания адекватной гемодинамики используются различные комбинации вазопрессорных катехоламинов.
Выполняется срединная стернотомия. Для защиты головного мозга может использоваться глубокая гипотермия, а также ретроградная цереброплегия во время полной остановки искусственного кровообращения, которая увеличивает время безопасной ишемии мозга с 15 до 30 минут.
Искусственное кровообращение проводиться в стандартном режиме – 2,4 л/мин/м 2 осуществляется посредством подключения по схеме: полые вены – аорта. Пациент охлаждается в течение 30 минут до достижения назофарингеальной температуры 15° С. Остановка сердца достигается анте- ретроградной кровяной кардиоплегией при 28° С. В случаях использования глубокой гипотермии по достижении температуры 15° С, останавливается искусственное кровообращение, начинается ретроградная перфузия головного мозга. Вскрывается продольно ствол легочной артерии с продлением разреза на левую и правую ветви легочной артерии.
Вскрытие ветвей легочной артерии
Проводится тщательное отделение эмболов, сросшихся с интимой. Процедура выполняется крайне деликатно для предотвращения повреждения адвентиции, которое, в последующем, может привести к массивному кровотечению. Удаление эмболов проводится, по возможности, до лобарных или сегментарных артерий последовательно из обоих ветвей легочной артерии. Выполняется тщательный дебридмент остатков старых тромбов с помощью отсоса, а также сдавлением легких для освобождения легочных сосудов от остатков детрита.
Извлеченный тромбоэмбол
В последующем проводится ушивание артериотомных отверстий одно- или двухрядным швом, согревание занимает от одного до полутора часов. Восстанавливается легочная вентиляция в это время идеальной является постоянная инфузия простагландина-I с дозировкой 0,5-1 ед./мин. После окончания согревания искусственное кровообращение отключается. Правожелудочковая недостаточность не является важной проблемой, если проведена адекватная защита миокарда. Использование добутамина или других катехоламинов проводится в зависимости от необходимости гемодинамической поддержки.
Послеоперационное ведение
Послеоперационное ведение не отличается от обычного ведения раннего послеоперационного периода у пациентов после использования искусственного кровообращения с постоянным контролем параметров гемодинамики, артериального и венозного давления, сатурации кислорода и т.д. Для поддержания гемодинамики возможна комбинация добутамина с фенилэпинефрином в комбинации с простагландинами и допамином. При необходимости используются небольшие дозы амринона или милринона.
При проведении искусственной вентиляции легких на начальном этапе раннего послеоперационного периода используется положительное давление на выдохе (5 мм рт. ст.) и инсуфляция 80-100% кислорода. Большинство больных экстубируется через 16-18 часов. Часть из пациентов в случаях гипоксемии и гидрокарбии требует вентиляционной поддержки в течение 1-2 недель с использованием положительного давления на выдохе.
Для профилактики инфекционных осложнений используется комбинация антибиотиков: цефалоспорина или ванкомицина в течение 3-х дней или во время всего периода искусственной вентиляции. Возобновление введения гепарина начинается после окончания поступления крови по дренажам, достижения частичного тромбопластинового времени 50-60 сек. В послеоперационном периоде рекомендовано применение комбинации непрямых антикоагулянтов (варфарин) с небольшими дозами аспирина (80 мг ежедневно) для поддержания МНО – 2,8-3,5.
Осложнения
Осложнения в послеоперационном периоде не отличаются от осложнений у пациентов, которым параллельно проводилась различная коррекция патологии сердца с использованием искусственного кровообращения. К ним относятся аритмии, ателектазы, раневые инфекции, пневмония или кровотечение.
Реперфузионные повреждения легких у большинства пациентов развиваются вследствие повышенной проницаемости легочного сосудистого русла для активированных нитрофилов. Они проявляется в первые 24 часа после выполнения операции и характеризуется артериальной гипоксемией, что рентгенологически проявляется инфильтратами в области сегментов легких, подвергшихся тромбэндартерэктомии. Тяжесть реперфузионных повреждений варьирует от средних форм, проявляющихся в послеоперационном периоде гипоксимией до реперфузионного отека легких, который может развиться в течение первых 2-3 дней после операции. Реперфузионный отек легких увеличивает физиологический шунт более чем на 30%, повышая необходимость в достижении высокого давления кислорода и снижения легочного комплайнса. Этот процесс также уменьшает количество легочного сурфактанта, приводит к ателектазам, с последующим развитием пневмонии. Реперфузионный отек легких очень похож на острый респираторный дистресс-синдром и должен лечиться агрессивным введением диуретиков, вентиляционной поддержкой с режимом положительного давления на выдохе, профилактикой инфекции в течение всего послеоперационного периода. Для коррекции возникших нарушений, как правило, назначается NO, который улучшает газообмен, однако не снижает необходимости вентиляционной поддержки и не увеличивает выживаемость. Наиболее оптимальным способом лечения является использование ЭКМО.
Злокачественная легочная артериальная гипертензия (спазм сосудов), в основном, должна контролироваться профилактическим назначением протагландина-I. Несмотря на то, что после окончания искусственного кровообращения у таких пациентов давление в легочной артерии составляет 50-60% системного и сравнимо с тем, что было до операции, в течение нескольких дней легочное давление значительно повышается, несмотря на использование нитроглицерина, гипокарбии, антихолиноэстеразных ингибиторов, добутамина, изопротеренола. Если не удается добиться снижения констрикции легочных артерий у этих больных развивается тяжелая правожелудочковая недостаточность. Механизм развития злокачественной легочной гипертензии не известен. K.M. Moser et al.(1985) считает, что этот феномен является «vascular steal» — «сосудистой кражей» и обусловлен гиперперфузией вследствие открытия легочного сосудистого русла после тромбэктомии. Несмотря на то, что в последнее время используется NO, способный снижать послеоперационное давление в легочной артерии с одновременным улучшением оксигенации, этого бывает недостаточно.
Остаточная легочная гипертензия после тромбэндартерэктомии, как правило, обусловлена невозможностью полного удаления эмболов из мелких артерий. Она сопровождается правожелудочковой недостаточностью. Основными направлениями в лечении являются снижение потребления кислорода, увеличение преднагрузки правого желудочка и агрессивная инотропная поддержка. Использование NO может улучшить газообмен у пациентов с тяжелыми реперфузионными повреждениями, но, как уже было сказано, не уменьшает необходимости в вентиляционной поддержке и не увеличивает выживаемость.
Неврологические осложнения, в основном, связаны с использованием глубокой гипотермии и обычно нивелируются в течение 2-3 дней после операции. Более тяжелые неврологические нарушения связаны с продленной остановкой кровообращения (больше 60 минут). [Fedullo P.F., Rubin L.J., Kerr K.M. et al., 2000].
Результаты. К 2003 году были описаны приблизительно около 4000 тромбэндартерэктомий из легочной артерии, из них 1500 выполнены в одном центре. Госпитальная (30-дневная летальность) составляет от 5,4% до 27%. До 1990 года она была на уровне 12,6-37,5%, но с накоплением опыта в последующие годы летальность значительно снизилась и с 1996 года составляла в различных центрах от 5 до 24%.
Одним из основных факторов риска является высокое легочное сопротивление больше 1100 ед./сек.cм -5 и послеоперационная длительность ИВЛ больше 5 дней, частично — продленное время искусственного кровообращения. По данным различных исследователей тяжелое поражение легочной артерии со средним давлением больше 50 мм рт.ст. легочного столба и средним легочным сопротивлением > 1100 ед./сек.см -5 сопровождается значительно большей летальностью 37% против 8%, если эти цифры значительно ниже.
Летальность, в основном, обусловлена высоким общим риском операции на открытом сердце. Основными причинами смерти после благополучно проведенной операции являются развитие злокачественной легочной гипертензии, правожелудочковая недостаточность, перфузионные повреждениями легких, резидуальная легочная гипертензия, кровотечение и другие осложнения, связанные с неврологическими нарушениями и правожелудочковой недостаточностью.
Улучшение давления наполнения правого желудочка и снижение давления в легочной артерии происходит в течение ближайших дней и достигает 50-60% от предоперационного уровня и приближается к нормальному. Легочное сопротивление, в среднем, снижается с 900 до 260 ед./сек.cм-5, а сердечный выброс увеличивается с 3,7 до 5,7 л/мин. Недостаточность трехстворчатого клапана уменьшается или исчезает.
В раннем послеоперационном периоде наблюдается снижение легочного сопротивления приблизительно у 65% больных. Параллельно с этим наблюдается улучшение газообмена и толерантности к физической нагрузке. Большинство больных, находящихся в III и IV функциональном классе NYHA перед операцией, после операции имеет I-II функциональный класс NYHA.
Рентгенограммы до- и после легочной тромбэндартерэктомии
Ангиограммы до- и после проведения легочной тромбэндартерэктомии
Отдаленные результаты
76% пациентов после операции находятся в I функциональном классе NYHA, остальные 24% — во II. В отдаленном послеоперационном периоде редко отмечается гипоксемия. Значительно снижается легочное сопротивление, увеличивается сердечный выброс.
Динамика легочного сопротивления ( ед./сек./cм -5 )
При адекватной антикоагулянтной терапии повторные эмболии легочной артерии достаточно редки. Иногда наблюдается правожелудочковая недостаточность, связанная в основном со вторичным изменением микроциркуляторного легочного кровеносного русла.
Продолжительная антикоагулянтая терапия абсолютно рекомендована пациентам после тромбэндартерэктомии. Для достижения терапевтического эффекта, предотвращающего тромбозы и повторные тромбоэмболии в легочную артерию, необходимо поддерживать адекватный уровень МНО (2-2,5). Пациенты, которым выполнение адекватной тромбэндартерэктомии не возможно, являются кандидатами для трансплантации сердца.
Становиться все более очевидным, что легочная гипертензия, вызванная хронической легочной эмболией, не подлежит медикаментозному лечению. Единственной альтернативой легочной тромбэмболэктомии является трансплантация легких. Преимущества тромбэмболэктомии включают более низкую госпитальную смертность и хорошие отдаленные результаты без риска, связанного с хронической иммунодепрессией и отторжением аллотрансплантата. Дальнейший прогресс хирургического лечения должен помочь большему количеству пациентов с этой, в конечном счете, фатальной болезнью.
Профессор, доктор медицинских наук Ю.П. Островский
Источники: http://www.tiensmed.ru/news/tromboembolia-q7n.html, http://www.rmj.ru/articles/onkologiya/Profilaktika_diagnostika_i_lechenie_posleoperacionnoy_tromboembolii_legochnoy_arterii/, http://cardiolog.org/cardiohirurgia/operacii-na-serdce/xir-tela.html