Рак молочной железы тромбоз глубоких вен
Рак и тромбоз: старые проблемы, новые рекомендации

До змiсту номера
Тромбоз глубоких вен нижних конечностей и тромбоэмболия легочной артерии (ТЭЛА) представляют собой наиболее опасные осложнения «естественной истории опухоли». Наличие рака в организме является основным фактором риска венозного тромбоза. За последние 50 лет смертность в течение первого месяца после хирургических операций у онкологических больных снизилась с 8,7 до 0,7%, что напрямую связано с внедрением тактики профилактического приема антикоагулянтов в до- и послеоперационном периоде.
Венозный тромбоз
Впервые это заболевание описал итальянский врач Джованни Баттиста Морганьи (1682-1771), который при вскрытии трупов нередко обнаруживал массивные венозные тромбы в легочной артерии.
Термин «эмболия» принадлежит немецкому физиологу и морфологу Рудольфу Вирхову (1821-1902). Он первым начал различать два типа тромбов: «…тот, который возникает в периферической вене и эмболизирует в легкие, и второй тип, который первично возникает в дистальных отделах легочной артерии в результате застойного кровотока». В те же годы были описаны патофизиологические механизмы формирования венозных тромбов, известные сегодня как триада Вирхова: замедление движения крови по сосудам, повреждение стенки сосуда и гиперкоагуляция.
В конце XIX века немецкий хирург Фридрих Тренделенбург для профилактики миграции тромбов из вен нижних конечностей в нижнюю полую вену предложил применять перевязку устья большой подкожной вены бедра. Несколько позже (1908) Тренделенбург попытался выполнить тромбэктомию из легочной артерии, однако успешно эту операцию смог провести только его ученик – Киршнер (1924). После этих операций в 30-е гг. ХХ века в каждой клинике Германии предписывалось иметь прикроватные хирургические наборы для экстренной тромбэктомии из легочной артерии у каждого оперированного пациента. За 10 лет было выполнено 300 подобных операций, но выжили всего 10 больных.
В 1944 г. известный хирург Альтон Ошнер в обращении к Американской хирургической ассоциации призвал проводить профилактику легочной эмболии и настаивал на том, что хирургическое лечение ТЭЛА должно отойти в прошлое.
В те годы уже имелись все условия для медикаментозной профилактики венозных тромбозов.
В 1916 г. студент Джей Мак Леан открыл первый антикоагулянт, который позже был назван гепарином. В конце 1920-х гг. Чарльз Бест (лауреат Нобелевской премии) и сотрудники его лаборатории в Университете Торонто получили очищенный гепарин. Первые клинические испытания по профилактическому использованию гепарина провел в 1935 г. Гордон Мюррей. Его работы способствовали развитию методов гемодиализа и трансплантации почки.
В 1930-х гг. Пауль Линк открыл варфарин, который широко используется в клинической практике с 1955 г. В первые 50 лет после открытия этот препарат опережал коммерческий гепарин по объему продаж.
В 1966 г. началось производство низкомолекулярных гепаринов – антитромботического препарата кальципарина.
Рак и тромбоз
Первым связь между венозным тромбозом и раком установил французский врач Арман Трюссо (1861). В своей лекции «Сочетание phlegmasia alba dolens и опухолевой кахексии» он говорил, что «при раковой кахексии состояние крови предрасполагает к ее спонтанной коагуляции». Синдром Трюссо (тромботическая маска рака) сегодня относят к паранеопластическим процессам. По иронии судьбы, через 5 лет после знаменитой лекции у самого Трюссо развился флебит, и позже был обнаружен рак желудка. Трюссо писал: «…у меня возник флебит, который просто не оставляет мне никаких сомнений относительно характера моей болезни».
Венозный тромбоз действительно сопутствует раку.
По данным V. Shen и Е. Pollak, еще 25 лет назад 1 из 7 госпитализированных онкологических пациентов умирал от ТЭЛА. Рак повышает риск тромбоэмболических осложнений в 4-6 раз, венозные тромбозы возникают у 15% онкологических пациентов. Смертность онкологических больных с тромбоэмболическими осложнениями в 2-3 раза выше по сравнению с онкологическими больными без тромбозов.
Известно, что пациенты с идиопатическим венозным тромбозом имеют повышенный риск развития рака в последующие годы. Рак, диагностированный в течение 1 года после выявления идиопатической венозной тромбоэмболии (ВТЭ), имеет более распространенную стадию и ассоциируется с худшей выживаемостью, чем недавно диагностированное онкологическое заболевание, которому не предшествовал венозный тромбоз.
До 80% послеоперационных периферических тромбозов протекают без клинических проявлений и обнаруживаются лишь с возникновением ТЭЛА или при аутопсии.
Биология рака влияет на частоту венозных тромбозов: при аденокарциноме риск выше, чем при плоскоклеточном раке. Максимальный риск возникновения тромбозов характерен для рака поджелудочной железы, опухолей головного мозга, рака яичника, матки, желудка и почки. Частота тромбозов повышена (в связи с широкой распространенностью заболевания) при раке легкого и колоректальном раке.
В то же время опухоли головы и шеи, рак молочной железы, рак предстательной железы сопровождаются более низким риском развития венозных тромбозов, и при оценке необходимости тромбопрофилактики у таких пациентов на первый план выступают другие факторы.
К венозному тромбозу у онкологических больных обычно приводят постельный режим, сдавление вен опухолью, повреждение сосуда (интравазация опухолевых клеток, химический флебит, механическое повреждение сосудов в результате терапевтических мероприятий).
Патологическая активация системы гемостаза при раке обусловлена поступлением из опухолевых клеток в кровоток высокоактивного тканевого фактора и специфических раковых прокоагулянтов. Особенно предрасположены к развитию венозных тромбозов больные с аденокарциномами, секретирующими муцин. Онкологический процесс сопровождается также повышением активности плазминогена, снижением уровня антитромбина III и естественных антикоагулянтов. Простациклин и тромбоксан также освобождаются травмированными эндотелиальными и раковыми клетками, приводя к адгезии и агрегации тромбоцитов. Цистеиновые протеазы, которые экспрессируются только раковыми клетками и амниотической тканью, способны активировать фактор Х в отсутствие фактора VIIa и запускать коагуляционный каскад. Кроме того, риск тромбозов повышается благодаря воспалительному ответу тканей и клеток на опухоль – цитокины, выделяемые в значительном количестве опухолью и клетками крови, повышают агрегацию тромбоцитов и активируют их.
В крови онкологического больного активированные тромбоциты способствуют адгезии опухолевых клеток к эндотелиальным, приводя к их миграции через стенку сосуда путем высвобождения гепараназы. При метастатической прогрессии тромбоциты находятся на поверхности циркулирующих опухолевых клеток и защищают их от повреждения клетками иммунной системы.
Серьезной причиной повышенного риска тромбозов у онкологических больных могут стать противоопухолевые лечебные мероприятия – в первую очередь обширные хирургические вмешательства и цитотоксическая химиотерапия. Повышенное тромбообразование связано с прямой органоспецифической токсичностью препаратов, повышением уровня прокоагулянтных молекул, снижением уровня эндогенных антикоагулянтов, апопотозом клеток эндотелия с высвобождением цитокинов, увеличением активности тканевого фактора, активацией тромбоцитов, моноцитов и макрофагов.
Любые хирургические вмешательства при наличии онкологических заболеваний рассматриваются как операции с высоким риском венозных тромбозов.
Принятие клинического решения о проведении медикаментозной профилактики основывается на определении физической активности пациента (госпитализация резко повышает риск осложнений), индивидуального тромботического риска, а также риска развития кровотечения.
Оценка риска тромботических осложнений
Индивидуальный тромботический риск связан с наличием одного или более факторов:
• активная опухоль или онкологическое лечение;
• снижение мобильности на ≥3 дня или потребность в постороннем уходе;
• возраст >60 лет;
• хирургическое вмешательство под общей анестезией продолжительностью >90 мин;
• ожирение (ИМТ >30 кг/м 2 );
• хирургическая операция в области малого таза или нижних конечностей продолжительностью >60 мин под общей анестезией;
• хирургическое вмешательство, ограничивающее подвижность;
• коморбидность (≥1 сопутствующих заболеваний);
• наличие острой хирургической патологии;
• протезы бедра или коленного сустава;
• перелом бедренной кости;
• венозные тромбозы в анамнезе;
• заместительная гормонотерапия или эстроген-содержащая контрацептивная терапия;
• дегидратация;
• тромбофилия;
• варикозно расширенные вены или флебиты;
• беременность или ранний послеродовой период (6 недель после родов).
Для амбулаторных больных, получающих химиотерапию, степень риска венозных тромбозов определяется по шкале Хорана. Больные с карциномой поджелудочной железы и пациенты с миеломой, получающие базовую терапию, автоматически относятся к группе высокого риска (табл. 1).
амбулаторных больных, получающих химиотерапию, степень риска венозных тромбозов определяется по шкале Хорана. Больные с карциномой поджелудочной железы и пациенты с миеломой, получающие базовую терапию, автоматически относятся к группе высокого риска (табл. 1).
В рутинной практике все пациенты при поступлении в стационар должны быть оценены с точки зрения риска развития венозного тромбоза и кровотечения (шкалы Каприни и АССР). Риски регулярно оцениваются в течение 24 ч после госпитализации и, как минимум, каждые 48 ч после госпитализации.
Немаловажно, что проблема профилактики тромбозов недооценена самими врачами. В итоге тромбоз глубоких вен и ТЭЛА характеризуются прижизненной гиподиагностикой и недостаточно эффективным лечением, хотя выявляются при аутопсии у 50% больных метастатическим раком.
Фундаментальное обсервационное исследование FRONTLINE, проведенное в 2001-2003 гг., показало, что профилактику тромбоза после операций у онкологических больных проводят 50% хирургов и только 5% онкологов. Среди химиотерапевтов распространено мнение, что риск тромбообразования у онкологических больных низок.
К сожалению, в Украине еще в 2011 г. до 50% врачей считали, что для профилактики венозных тромбозов достаточно приема аспирина.
Выбор антикоагулянта и продолжительность профилактики
Современные требования, предъявляемые к антикоагулянтам в онкологической практике, включают удобный способ введения фиксированной дозы, отсутствие необходимости лабораторного мониторинга на фоне терапии, совместимость с препаратами для химиотерапии и в целом приемлемый профиль лекарственных взаимодействий, низкий риск кровотечений, а также наличие доказательной базы.
Современным требованиям соответствуют низкомолекулярные гепарины (НМГ) – биологические препараты похожего молекулярного веса (меньшего, чем в молекуле эндогенного гепарина), но обладающие индивидуальными биологическими, фармакологическими и клиническими характеристиками. Многочисленные международные рандомизированные исследования свидетельствуют о большей эффективности НМГ по сравнению с нефракционированным гепарином (НФГ), что связано с блокированием преимущественно Xа фактора свертывания крови. Способность НМГ стимулировать выход из эндотелия ингибитора пути тканевого фактора (который может секретироваться опухолью) крайне актуальна для онкологических больных. Кроме того, НМГ имеют низкий риск тромбоцитопении, отличаются высокой биодоступностью и быстрым началом действия, поскольку не связываются с клетками и белками плазмы. Препарат вводится 1-2 раза в сутки и может использоваться для профилактики и лечения венозных тромбозов в стационаре и амбулаторных условиях. Помимо всех перечисленных преимуществ, НМГ не требуют ежедневного лабораторного мониторинга, обеспечивают более предсказуемый, чем НФГ, антикоагулянтный ответ и обладают более предсказуемыми фармакокинетическими свойствами (включая клиренс и лекарственные взаимодействия). Дисфункция желудочно-кишечного тракта не влияет на подкожное введение препарата. Особенности дозирования НМГ у онкологических больных отражены в табл. 2, 3.

Профилактика венозных тромбозов посредством назначения НМГ проводится в обязательном порядке при госпитализации онкологического больного по поводу ургентного состояния, а также у онкологических больных, перенесших серьезные операции.
Профилактика НМГ сроком до 4 недель проводится у онкологических больных, подвергшихся тазовой или абдоминальной хирургической операции при наличии признаков высокого риска (неподвижность, ожирение, истории ВТЭ в анамнезе). Резюме международных рекомендаций по стандартной и продленной профилактике ВТЭ у хирургических онкологических пациентов в стационаре представлено в табл. 4.
Пациенты с активной формой метастазирующего рака, которым назначен тот или иной вид комбинированной противоопухолевой терапии, должны получать НМГ на протяжении не менее 6 мес. Пациенты со случайно выявленными бессимптомными тромбозом глубоких вен и ТЭЛА должны получать НМГ так же, как и при симптомных ВТЭ. При ТЭЛА мелких ветвей вопрос решается индивидуально.
Профилактика с помощью НМГ не показана амбулаторным онкологическим больным с низким тромботическим риском, а также пациентам с высоким риском кровотечения (например, при первичных опухолях головного мозга).
После выявления опухоль-ассоциированной ВТЭ монотерапию НМГ следует продолжать минимум 6 мес – как и в том случае, если у пациента имеется персистирующая злокачественная прогрессия и планируется продолжение противоопухолевой терапии. Для пациентов с низким риском рецидива спустя 6 мес антикоагулянтная терапия может быть прекращена при отсутствии активного злокачественного процесса (излечение либо ремиссия) и при условии, что они в дальнейшем не будут получать никакой противоопухолевой терапии. Лечение антикоагулянтами должно быть продолжено у пациентов с высоким риском рецидива, но с периодически повторяющейся оценкой риск/польза.
При ВТЭ, рецидивирующей на фоне приема антикоагулянтов, онкологическому пациенту должны быть назначены НМГ в терапевтической дозе, если ранее он получал препараты других групп либо НМГ в недостаточной дозе. Если осложнение возникло на фоне приема терапевтической дозы НМГ, дозу препарата следует увеличить на 25%. Кава-фильтры следует устанавливать только при наличии абсолютных противопоказаний к НМГ (например, активное кровотечение).
Таким образом, применение низкомолекулярных гепаринов у онкологических пациентов необходимо рассматривать как обязательный компонент комплексного лечения на разных этапах лечебного процесса.
Литература
1. Khalil et al. Venous thromboembolism in cancer patients: an underestimated major health problem. World J of Surg Oncology, 2015; 13: 204.
2. Lyman G.H. et al. Venous thromboembolism prophylaxis and treatment in patients with cancer: American society of clinical oncology clinical practice guideline update 2014. J Clin Oncol, 2015; 33: 654-656.
3. Gould M.K. et al. Prevention of VTE in nonorthopedic surgical patients: antithrombotic therapy and prevention of thrombosis, 9th ed: American college of chest physicians evidence-based clinical practice guidelines. Chest, 2012; 141(Suppl): e227s-e277s.
4. Mandala M. et al. Venous thromboembolism in cancer patients: ESMO clinical practice guidelines for the management. Annals of Oncolog, 2010; 21(Supp l.5): v274-v276.
5. Streiff M.B. et al. Cancer-Associated Venous Thromboembolic Disease, Version 1.2015. J Natl Compr Canc Netw, 2015; 13(9): 1079-95.
6. Kakkar A.K. et al. Venous thrombosis in cancer patients: insights from the FRONTLINE survey. Oncologist, 2003; 8(4): 381-8.
7. Shen V.S., Pollak E.W. Fatal pulmonary embolism in cancer patients: is heparin prophylaxis justified? South Med J, 1980 Jul; 73(7): 841-3.
Спеціальний випуск тематичного номеру газети «Здоров’я України» «Онкологія, гематологія, хіміотерапія» 2017 р.
СТАТТІ ЗА ТЕМОЮ Онкологія та гематологія
За ініціативи Національного інституту раку (НІР) щороку проводиться конференція, присвячена хірургічному лікуванню пухлин шлунково-кишкового тракту. Цього року вирішено виокремити тематику гепатопанкреатобіліарної хірургії, що продиктовано великою зацікавленістю спеціалістів цією проблемою. Захід об’єднав провідних науковців і лікарів-практиків у галузі онкології та хірургії з України, США, Італії, Німеччини та Швеції.
Согласно статистическим данным, в 2012 году в мире зарегистрировано 238 719 новых случаев рака яичника (РЯ) и 151 917 (63,6%) случаев смерти от данной патологии. По прогнозам, в 2020 году во всем мире будет зарегистрировано до 190 000 новых случаев РЯ. В Украине, согласно данным Канцер-реестра, в 2015 году выявлено 3477 новых случаев РЯ и 1862 (53,5%) случаев смерти от РЯ. Выделяют эпителиальные и неэпителиальные типы РЯ. Эпителиальные опухоли составляют более 90% всех случаев РЯ. .
У рамках VIII науково-практичної конференції «Перспективи діагностики та лікування гематологічних захворювань» особливу увагу привернуло секційне засідання, присвячене проблемним питанням тромбоцитопенії. На засіданні були розглянуті різні аспекти тромбоцитопенії, а також наявні терапевтичні можливості, серед яких особливе місце займає рекомбінантний людський тромбопоетин (рлТПО). .
21-22 травня в м. Києві відбувся міжнародний науковий симпозіум «Фундаментальні засади біотерапії злоякісних новоутворень», організований Інститутом експериментальної патології, онкології і радіобіології (ІЕПОР) ім. Р.Є. Кавецького Національної академії наук України (НАНУ). Симпозіум був присвячений фундаментальним дослідженням, прикладним аспектам, сучасному і майбутньому використанню протипухлинних вакцин. Він проводився у рамках проекту TWINNING VACTRAIN (використання протипухлинних вакцин на базі ДНК), який отримав підтримку з програми досліджень та інновацій Європейського Союзу «Горизонт-2020». .
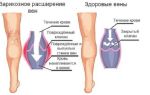
Тромбозы и тромбофлебиты вен нижних конечностей: этиология, диагностика и лечение
Для цитирования: Гивировская Н.Е., Михальский В.В. Тромбозы и тромбофлебиты вен нижних конечностей: этиология, диагностика и лечение // РМЖ. 2009. №25. С. 1663
Венозный тромбоз – острое заболевание, вызванное свертыванием крови в просвете вены, что приводит к нарушению ее проходимости. Следует различать понятия «тромбофлебит» и «флеботромбоз». Флебитом называется воспаление стенки вены вследствие общей или местной инфекции. Флеботромбоз развивается за счет изменения коагуляционных свойств крови, повреждении сосудистой стенки, замедления тока крови и т.д. [1].
 90695 0
90695 0
 Введение
Введение
Острые тромбозы глубоких вен и тромбофлебиты поверхностных вен нижних конечностей являются распространенными заболеваниями и встречаются у 10–20% населения, осложняя в 30–55% случаев течение варикозной болезни [2]. В подавляющем большинстве случаев тромбофлебиты локализуются в поверхностных венах. Тромбоз глубоких вен нижних конечностей развивается в 5–10% случаев [3]. Крайне опасная для жизни ситуация возникает при флотирующем тромбе в связи с развитием тромбоэмболии легочной артерии (ТЭЛА). Флотирующая верхушка тромба имеет высокую подвижность и расположена в интенсивном потоке крови, что препятствует ее адгезии к стенкам вены. Отрыв венозного тромба может вести к массивной тромбоэмболии (немедленная смерть), субмассивной ТЭЛА (выраженная гипертензия в малом круге кровообращения со значениями давления в легочной артерии 40 мм рт.ст. и выше) или тромбоэмболии мелких ветвей легочной артерии с клиникой дыхательной недостаточности и так называемой инфаркт–пневмонии [4]. Флотирующие тромбы встречаются примерно в 10% всех острых венозных тромбозов. Тромбоэмболия легочной артерии в 6,2% случаев приводит к летальному исходу [5].
Не менее важное значение имеют другие последствия тромбоза вен нижних конечностей, который через 3 года в 35–70% приводит к инвалидности, обусловленной хронической венозной недостаточностью на фоне посттромбофлебитического синдрома [6].
Венозные тромбозы полиэтиологичны. В патогенезе тромбообразования имеют значение нарушения структуры венозной стенки, замедление скорости кровотока, повышение коагуляционных свойств крови (триада Вирхова) и изменение величины электростатического потенциала между кровью и внутренней стенкой (Z потенциал) [1].
По этиологии выделяют венозные тромбозы:
• застойные (при варикозной болезни вен нижних конечностей, вследствие экстравенозной компрессии вен и интравенозного препятствия току крови);
• воспалительные (постинфекционные, посттравматические, постинъекционные, иммунно–аллергические);
• при нарушении системы гемостаза (при онкологических заболеваниях, болезнях обмена веществ, патологии печени).
По локализации:
• тромбофлебит поверхностных вен нижних конечностей (основного ствола большой, малой подкожных вен, притоков подкожных вен и их сочетания);
• тромбоз глубоких вен нижних конечностей (берцово–подколенный сегмент, бедренный сегмент, подвздошный сегмент и их сочетания).
По связи тромба со стенкой вены возможны варианты:
• окклюзивный тромбоз,
• пристеночный тромбоз,
• флотирующий,
• смешанный.
Клиническая картина тромбоза и тромбофлебита вен нижних конечностей
Острый тромбофлебит поверхностных вен нижних конечностей чаще развивается в большой, нежели в малой, подкожной вене и ее притоках и является, как правило, осложнением варикозного расширения вен. Для него типична выраженность местных воспалительных изменений в области пораженных подкожных вен, поэтому диагностика его проста и доступна. Спонтанный тромбофлебит без расширения вен нередко является следствием гинекологической патологии или первым симптомом злокачественного новообразования органов желудочно–кишечного тракта, предстательной железы, почек и легких. Первым проявлением заболевания служит боль в тромбированном участке вены. По ходу уплотненной вены появляется гиперемия кожи, инфильтрация окружающих тканей, развивается картина перифлебита. Пальпация тромбированного участка вены болезненна. Возможно ухудшение общего самочувствия, проявляющееся симптомами общевоспалительной реакции – слабость, недомогание, озноб, повышение температуры тела до субфебрильных цифр, а в тяжелых случаях до 38–39°С. Регионарные лимфатические узлы обычно не увеличены.
Наиболее характерным клиническим признаком острого тромбоза глубоких вен нижних конечностей является внезапно возникающая боль, усиливающаяся при физическом напряжении (ходьбе, стоянии). Затем возникает отек тканей, сопровождающийся чувством распирания и тяжести в конечности, повышением температуры тела. Кожные покровы дистальнее места тромбоза обычно цианотичны, блестящие. Температура пораженной конечности выше на 1,5–2°С по сравнению со здоровой. Пульсация периферических артерий не нарушена, ослаблена или отсутствует. На 2–3–й день от начала тромбоза появляется сеть расширенных поверхностных вен.
Тромбоз глубоких вен при вовлечении в процесс только вен икроножных мышц или 1–2 глубоких магистральных вен сопровождается стертой клинической картиной. Единственным признаком тромбоза в таких случаях служат боль в икроножных мышцах и незначительный отек в области лодыжки.
Клинические проявления тромбофлебита поверхностных вен нижних конечностей и тромбоза глубоких вен не всегда специфичны. У 30% больных с поверхностным тромбофлебитом истинная распространенность тромбоза на 15–20 см превышает клинически определяемые признаки тромбофлебита. Скорость нарастания тромба зависит от многих факторов и в некоторых случаях она может достигать 20 см в сутки. Момент перехода тромбоза на глубокие вены протекает скрытно и далеко не всегда определяется клинически [7].
Поэтому, помимо данных общеклинического обследования, наличие тромбоза вен нижних конечностей подтверждается на основании специальных методов диагностики.
Методы диагностики тромбозов глубоких и тромбофлебитов поверхностных вен нижних конечностей
Существует множество методов обследования венозной системы нижних конечностей: ультразвуковая допплерография, дуплексное сканирование, флебография, КТ–флебография, фотоплетизмография, флебосцинтиография, флебоманометрия. Однако среди всех инструментальных методов диагностики максимальной информативностью обладает ультразвуковое ангиосканирование с цветным картированием кровотока [8]. На сегодняшний день метод является «золотым» стандартом диагностики патологии вен. Метод неинвазивен, позволяет адекватно оценить состояние вены и окружающих ее тканей, определить локализацию тромба, его протяженность и характер тромбоза (флотирующий, неокклюзивный пристеночный, окклюзивный), что крайне важно для определения дальнейшей лечебной тактики (рис. 1).
В тех случаях, когда ультразвуковые методы недоступны либо малоинформативны (тромбоз илеокавального сегмента, особенно у тучных больных и у беременных), применяют рентгенконтрастные методы. В нашей стране наибольшее распространение получила ретроградная илиокаваграфия. Подключичным или яремным доступом диагностический катетер проводится в нижнюю полую и подвздошные вены. Вводится контрастное вещество и выполняется ангиография. При необходимости из этого же доступа можно выполнить имплантацию кава–фильтра. В последние годы начали применяться малоинвазивные рентгенконтрастные методики – спиральная компьютерная томоангиография с 3D–реконструкцией и магнитно–резонансная томоангиография.
Из лабораторных исследований заподозрить венозный тромбоз позволяет обнаружение критических концентраций продуктов деградации фибрина (D–димер, РФМК – растворимые фибрин–мономерные комплексы). Однако исследование не специфично, поскольку РФМК и D–димер повышаются и при ряде других заболеваний и состояний – системные болезни соединительной ткани, инфекционные процессы, беременность и т.д.
Лечение больных с тромбофлебитами и тромбозами вен нижних конечностей
Лечение больных с тромбофлебитами и тромбозами вен нижних конечностей должно быть комплексным, включать консервативные и хирургические методы.
С ноября 2008 г. по октябрь 2009 г. в ГКБ №15 им. О.М. Филатова на стационарном лечении находились 618 пациентов с острой патологией вен нижних конечностей. Из них мужчин – 43,4% (n=265), женщин – 66,6% (n=353), Средний возраст составил 46,2 лет. Восходящий тромбофлебит большой подкожной вены отмечался у 79,7% (n=493), тромбоз глубоких вен нижних конечностей – у 20,3% (n=125) пациентов.
Всем пациентам проводилась консервативная терапия, направленная на улучшение микроциркуляции и реологических свойств крови, угнетение адгезивно–агрегационной функции тромбоцитов, коррекцию венозного кровотока, оказание противовоспалительного и десенсибилизирующего действия. Основными задачами консервативного лечения является профилактика продолженного тромбообразования, фиксация тромба к стенкам сосуда, ликвидация воспалительного процесса, а также воздействие на микроциркуляцию и тканевой обмен. Важным условием лечения является обеспечение конечности функционального покоя и профилактика тромбоэмболических осложнений. С этой целью больным в раннем периоде заболевания назначается постельный режим с возвышенным положением нижней конечности. При тромбозе глубоких вен голени длительность постельного режима составляет 3–4 суток, при подвздошно–бедренном тромбозе – 10–12 суток.
Однако основной является антикоагулянтная терапия при строгим лабораторном контроле показателей системы гемостаза. В начале заболевания применяются прямые антикоагулянты (гепарин или гепарин низкомолекулярной массы – фраксипарин). Чаще всего применяется следующая схема гепаринотерапии: 10 тыс. ЕД гепарина внутривенно и по 5 тыс. ЕД внутримышечно каждые 4 ч в первые сут, на вторые сут – по 5 тыс. ЕД каждые 4 ч, в дальнейшем по 5 тыс. ЕД гепарина каждые 6 ч. К окончанию первой недели лечения пациент переводится на непрямые антикоагулянты (блокаторы синтеза витамин К–зависимых факторов свертывания крови): за 2 дня до отмены гепаринотерапии пациентам назначаются непрямые антикоагулянты, а суточная доза гепарина снижается в 1,5–2 раза за счет уменьшения разовой дозы. Эффективность гепаринотерапии контролируется такими показателями, как время кровотечения, время свертывания и активированное частичное тромбопластиновое время (АЧТВ), антикоагулянтной терапии непрямыми антикоагулянтами – протромбиновый индекс (ПТИ), международное нормализованное отношение (МНО).
Для улучшения микроциркуляции и реологических свойств крови, все пациенты получали внутривенное введение пентоксифиллина (оригинальный препарат Трентал® компании Санофи–Авентис) 600 мг/сут., который является производным метилксантина. В настоящее время препарат является одним из наиболее часто и успешно используемых препаратов в ангиологической практике, включен в стандарты лечения больных с венозной и артериальной патологией. В результате применения пентоксифиллина отмечают улучшение микроциркуляции и снабжения тканей киcлородом. Механизм действия пентоксифиллина связывают с угнетением фосфодиэстеразы и накоплением цАМФ в клетках гладкой мускулатуры сосудов, в форменных элементах крови. Пентоксифиллин тормозит агрегацию тромбоцитов и эритроцитов, повышает их гибкость, снижает повышенную концентрацию фибриногена в плазме и усиливает фибринолиз, что уменьшает вязкость крови и улучшает ее реологические свойства. Кроме того, пентоксифиллин оказывает cлабое миотропное сосудорасширяющее действие, несколько уменьшает общее периферическое сосудистое сопротивление и обладает положительным инотропным эффектом. Также установлено, что препарат подавляет цитокин–опосредованную активацию нейтрофилов и адгезию лейкоцитов к эндотелию, снижает выделение свободных радикалов кислорода [9].
Оперативное лечение необходимо при возникновении риска развития тромбоэмболии легочной артерии.
При остром тромбофлебите поверхностных вен показания к хирургическому лечению возникают при росте тромба по большой подкожной вене выше уровня средней трети бедра. Классическим вариантом оперативного пособия является операция Троянова–Тренделленбурга или ее модификация – кроссэктомия. Операция Троянова–Тренделленбурга заключается в приустьевой перевязке большой подкожной вены и пересечении ее ствола в пределах раны, что предотвращает распространение тромботического процесса на бедренную вену. Кроссэктомия отличается тем, что дополнительно выделяются и перевязываются все приустьевые притоки большой подкожной вены, в результате чего устраняется возможность рефлюкса через сафено–феморальное соустье. Оперативное лечение в виде кроссэктомии выполнено 85,4% (n=421) пациентов. Операция Троянова–Тренделленбурга не выполнялась. У 7,4% (n=31) больных во время операции необходимо было выполнение тромбэктомии из общей бедренной вены при наличии УЗИ–признаков пролабирования головки тромба через сафено–феморальное соустье. Летальных исходов у этих пациентов не отмечалось.
Показанием к хирургическому лечению пациентов с острыми тромбозами глубоких вен нижних конечностей является наличие признаков флотации головки тромба, выявленное при ультразвуковом исследовании. Флотирующий характер тромбоза верифицирован у 29,6% (n=37) больных. Выбор операции зависит от уровня проксимальной границы тромба. Поражение глубоких вен голеней наблюдалось у 14,4% (n=18), вен подколенно–бедренного сегмента – у 56,8% (n=71), подвздошных вен – у 23,2% (n=29), нижней полой вены – у 5,6% (n=7) пациентов. Оперативное лечение выполнено 48,6% (n=18) пациентов. Перевязка бедренной вены выполнена 30% (n=6) пациентов при выявлении флотирующего тромба в подколенной вене. У 44,4% (n=8) больных произведена эмболэктомия из общей бедренной и перевязка бедренной при верификации наличия флотирующего тромба в общей бедренной вене. Кава–фильтр в нижнюю полую вену установлен 25,6% (n=4) пациентов с флотирующим тромбозом подвздошных вен или нижней полой вены ниже уровня почечных вен. Случаев летальности у оперированных больных с тромбозами глубоких вен нижних конечностей не отмечалось. В группе больных с консервативной терапией тромбоза глубоких вен нижних конечностей умерло 4 пациента (3,2%).
В настоящее время проблема лечения пациентов с тромбофлебитами и тромбозами вен нижних конечностей является актуальной. Это связано с преимущественным возникновением заболеваний в работоспособном возрасте, частой инвалидизацией пациента, особенно после перенесенного тромбоза глубоких вен вследствие развития постромбофлебитического синдрома, риском летального исхода при развитии ТЭЛА. Всем пациентам необходима консервативная терапия, основу которой составляют анткоагулянтные препараты, препятствующие прогрессированию процесса или развитию ретромбоза. Для улучшения микроциркуляции и реологических свойств крови пациентам необходимо применение пентоксифиллина в дозировке 600 мг/сут., который обусловливает скорое уменьшение или исчезновение отека, болей в пораженной конечности. Оперативные методы лечения показаны при наличии угрозы ТЭЛА. При этом у пациентов с восходящим тромбофлебитом вен нижних конечностей необходимо выполнение кроссэктомии. Выбор операции при наличии флотирующего тромба в глубоких венах нижних конечностях зависит от уровня проксимальной границы тромбоза и включает в себя перевязку бедренной вены, эмболэктомию из общей бедренной с перевязкой бедренной вены, имплантацию кава–фильтра в нижнюю полую вену. Следует отметить, что все пациенты с выявленным тромбозом глубоких вен нижних конечностей должны рассматриваться, как больные с высоким риском развития ТЭЛА (даже при отсутствии признаков флотации головки тромба) и получать адекватную терапию в сочетании с контрольными УЗАС.
Тромбоз глубоких вен и тромбоэмболия лёгочной артерии у онкологических больных
ТЭЛА — закрытие просвета основного ствола или ветвей легочной артерии эмболом (тромбом), которое ведет к резкому уменьшению кровотока в легких.
Эпидемиология
Послеоперационные тромбоэмболии у онкологических больных развиваются в 5 раз чаще, чем у больных общехирургического профиля.
Причины тромбоза глубоких вен
Оперативные вмешательства у онкологических больных провоцируют возникновение тромба независимо от локализации опухоли и объема операции. В настоящее время доказана целесообразность профилактики тромбоза глубоких вен у больных, подвергаемых хирургическому лечению.
Вероятность венозных тромбозов зависит от нозологических форм опухолей. У больных раком лёгкого тромбозы обнаруживают в 28% случаев, при раке желудка, толстой кишки и поджелудочной железы их частота составляет 17, 16 и 18% соответственно. При раке предстательной железы, раке матки и яичников венозные тромбы отмечены в 7% случаев. Послеоперационные тромбозы глубоких вен нижних конечностей и таза выявляют у 60-70% оперированных больных, и в 70% случаев тромбоз протекает бессимптомно.
Симптомы тромбоза глубоких вен и ТЭЛА
При тромбозе глубоких вен после операции выявляют нарастающий отек конечности, плотность при пальпации икроножных мышц и болезненность по ходу поражённых вен, однако возможно и бессимптомное течение.
Клинически ТЭЛА следует заподозрить при внезапном появлении одышки, болей в грудной клетке, гипоксемии, тахикардии и снижении АД вплоть до шока ТЭЛА характеризуют как тяжелую при наличии артериальной гипотонии или шока средней тяжести (при ультразвуковых признаках снижения сократительной способности правого желудочка) и нетяжелую.
Классификация
Тромбоз глубоких вен классифицируют на проксимальный (выше подколенной ямки) и дистальный (ниже подколенной ямки).
Диагностика
Лабораторные исследования
Определение уровня О-димера в крови. Проведенные исследования показали, что у больных с ТЭЛА содержание D-димера возрастает в 10-15 раз по сравнению с больными без тромботических осложнений. Наиболее высокую концентрацию D-димера (12-15 мкг/мл) наблюдают у больных с массивной тромбоэмболией, у пациентов с тромбозом уровень D-димера составляет 3,8-6,5 мкг/мл.
Инструментальные исследования
Рентгенография грудной клетки, ЭКГ и ЭхоКГ при ТЭЛА малоинформативны.
Ультразвуковая допплерография сосудов нижних конечностей проводится 1 раз в 3-4 дня после операции у больных с хронической венозной недостаточностью. Метод обладает средней чувствительностью, особенно при дистальном тромбозе глубоких вен (30-50%).
Вентиляционно-перфузионная сцинтиграфия легких — неинвазивный, достаточно информативный (90%) метод диагностики ТЭЛА.
УЗИ вен нижних конечностей проводят в предоперационный период при:
- отёке голени или всей нижней конечности,
- болях в икроножной мышце при ходьбе,
- наличии варикозных узлов,
- болезненности при пальпации сосудистого пучка нижней конечности,
- ТЭЛА и тромбоз глубоких вен в анамнезе,
- ожирении,
- недостаточности кровообращения.
Немедикаментозиее лечение
При выявлении тромбоза глубоких вен показано внедрение кава-фильтра до операции.
Медикаментозное лечение
В качестве медикаментозного лечения показана антитромботическая и тромболитическая терапия.
Антитромботическая терапия — основа патогенетической фармакотерапии тромбоза глубоких вен, которая уменьшает его последствия, предотвращает дальнейшее прогрессирование и развитие осложнений. Показано назначение антикоагулянтов прямого и непрямого действия.
В качестве антикоагулянтов прямого действия назначают НФГ или НМГ.
- НФГ назначают при лечении венозных тромбозов в первоначальной дозе 5000 ЕД в/в или п/к, последующие введения осуществляют в/в капельно до 30 000 ЕД в сутки, дозу препарата контролируют преимущественно определением АЧТВ. При неосложненном венозном тромбозе терапию НФГ продолжают 5 сут. Применение препарата в течение 10-14 сут у больных с ТГВ и ТЭЛА стало обычным в клинической практике в США. В европейских странах длительность терапии гепарином натрия короче и составляет 4-5 сут. В России рекомендуют вводить гепарин натрия не менее 7 сут по схеме: НФГ в/в болюсом по 3000-5000 ЕД, затем п/к по 250 ЕД/кг, 2 раза в сутки, всего 5-7 дней. Дозу препарата подбирают следующим образом НФГ в/в болюсом по 80 ЕД/кг, затем в/в инфузионно по 18 ЕД/кгхч), но не менее 1250 ЕД/ч, 5-7 сут. Дозировать препарат необходимо таким образом, чтобы АЧТВ в 1,5-2,5 раза превышало нормальное его значение для лаборатории данного лечебного учреждения. В период подбора дозы АЧТВ определяют каждые 6 ч, при устойчивых терапевтических значениях показателя — 1 раз в сутки. Необходимо учесть, что потребность в гепарине выше в первые несколько суток после возникновения тромбоза.
- Применение НМГ не требует лабораторного контроля, однако при лечении тяжелой ТЭЛА предпочтение следует отдать НФГ, так как эффективность НМГ до конца не изучена. Препараты НМГ далтепарин натрий, надропарин кальций, эноксапарин натрий. Далтепарин натрий вводят под кожу живота по 200 анти-Ха МЕ/кг, максимально 18 000 анти-Ха МЕ 1 раз в сутки, при повышенном риске кровотечений по 100 анти-Ха МЕ/кг 2 раза в сутки, 5-7 сут. Надропарин кальций под кожу живота по 86 анти-Ха МЕ/кг 2 раза в сутки или 171 анти-Ха МЕ/кг, максимально 17 100 анти-Ха ME раз в сутки, 5-7 сут Эноксапарин натрий под кожу живота 150 анти-Ха МЕ/кг (1,5 мг/кг, максимально 180 мг) 1 раз в сутки или по 100 анти-Ха МЕ/кг (1 мг/кг) 2 раза в сутки, 5-7 сут.
- Антикоагулянты непрямого действия широко применяют при лечении тромбоза глубоких вен и ТЭЛА. Как правило, препараты назначают после стабилизации процесса с помощью гепаринов и одновременно с началом гепаринотерапии или в ближайшие дни, дозу подбирают по уровню МНО, целевые значения которого составляют 2,0-3,0. Предпочтение отдают антикоагулянтам непрямого действия кумаринового ряда (варфарин, аценокумарол) из-за лучших фармакокинетических свойств и более предсказуемого антикоагулянтного эффекта. Аценокумарол назначают внутрь по 2-4 мг в сутки (начальная доза), а поддерживающую дозу подбирают индивидуально под контролем МНО. Варфарин принимают внутрь по 2,5-5,0 мг/сут (начальная доза), поддерживающую дозу подбирают аналогично. Гепарины отменяют не ранее чем через 4 сут после начала приема антикоагулянтов непрямого действия и только при сохранении терапевтических значений МНО в течение двух последовательных дней. Длительность применения антикоагулянтов непрямого действия не менее 3-6 мес.
Тромболитическая терапия
В настоящее время нет очевидных доказательств преимущества тромболитической терапии перед применением гепарина натрия. Проведение тромболитической терапии при тромбозе глубоких вен практически невозможно из-за крайне высокой опасности геморрагических осложнений в ближайшем послеоперационном периоде. Подобный риск оправдан лишь в случаях угрозы жизни больного при массивной ТЭЛА. Тромболитические ЛС показаны пациентам с тяжелой ТЭЛА и артериальной гипотонией, шоком, рефрактерной гипоксемией или правожелудочковой недостаточностью. Тромболитическая терапия ускоряет процесс восстановления проходимости окклюзированной легочной артерии, уменьшения выраженности лёгочной гипертензии и постнагрузки на правый желудочек по сравнению с эффектом введения гепарина натрия. Однако убедительных доказательств того, что быстрое улучшение гемодинамических показателей улучшает клинические исходы при тяжёлой ТЭЛА, нет. Остаётся неясным, оправдан ли при этом более высокий риск развития геморрагических осложнений. Период эффективного применения тромболитической терапии составляет 14 с после появления её симптомов. Стрептокиназу и урокиназу применяют в качестве монотерапии. Введение алтеплазы сочетают с применением гепарина натрия, её можно назначить (или возобновить введение) после окончания тромболизиса, когда протромбиновое время или АЧТВ станут меньше, чем удвоенное нормальное значение. Назначают одно из следующих средств:
- алтеплаза в/в инфузионно по 100 мг в течение 2 ч,
- стрептокиназа в/в инфузионно по 250 000 ЕД в течение 30 мин, затем со скоростью 100 000 ЕД/ч в течение 24 ч,
- урокиназа в/в инфузионно по 4400 МЕ/кгхч) за 10 мин, затем со скоростью 4400 МЕ/кгхч) в течение 12-24 ч.
Хирургическое лечение
В специализированных ангиохирургических отделениях выполняют тромбэктомию в случаях сегментарного тромбоза бедренных, подвздошных и нижней полой вен. Радикальный характер вмешательства на магистральных венах устраняет опасность массивной ТЭЛА и улучшает отдалённый прогноз венозного тромбоза.
Вместе с тем тяжесть состояния больных, обусловленная характером и объемом первичного хирургического вмешательства и сопутствующими заболеваниями, позволяет прибегать к этой процедуре в весьма ограниченном числе случаев. Вот почему возникновение тромбов в бедренных, подвздошных или нижней полой венах заставляет помимо антикоагулянтной терапии прибегать к парциальной окклюзии нижней полой вены. Метод выбора у послеоперационного контингента больных — имплантация кава-фильтра. При невозможности проведения этого вмешательства у пациентов, которым предстоит операция на брюшной полости, она может быть начата с пликации нижней полой вены механическим швом.
Источники: http://health-ua.com/article/31230-rak-i-tromboz-starye-problemy-novyerekomendatcii, http://www.rmj.ru/articles/khirurgiya/Trombozy_i_tromboflebity_ven_nighnih_konechnostey__etiologiya_diagnostika_i_lechenie/, http://m.ilive.com.ua/health/tromboz-glubokih-ven-i-tromboemboliya-lyogochnoy-arterii-u-onkologicheskih-bolnyh_108849i15957.html