Тромбоз глубоких вен и лучевая терапия
Развитие тромбофлебита после химиотерапии
Поверхностный тромбофлебит представляет собой воспаление поверхностных вен с формированием внутрисосудистых тромбов.
Поверхностный тромбофлебит обычно развивается при введении различных цитостатиков, особенно после длительного нахождения в вене катетера, после травм и т. п. Это достаточно частое осложнение, которое возникает во время химиотерапии.
Факторы риска, способствующие возникновению тромбофлебита:
• длительная обездвиженность пациента,
• использование некоторых лекарственных средств (например, гормональных контрацептивов),
• наследственность.
Мигрирующий тромбофлебит — это развитие повторных тромбофлебитов, возникающих, а различных участках неповрежденных вен. Данный вид тромбофлебита является веским поводом для детального обследования, так как он может являться косвенным маркером опухолей и сопутствовать им.
• Болевые ощущения по ходу вены, а также в местах инъекций или установки катетера.
• Резкая болезненность во время надавливания и уплотнение вены.
• Местная гипертермия (повышение температуры).
• Покраснение кожи над воспаленной веной.
• Отек конечности.
• Лихорадка, чувство озноба и прочие гриппоподобные симптомы.
Методы диагностики
Обычно для постановки предварительного диагноза поверхностного тромбофлебита достаточно провести стандартный опрос и осмотр пациента. Дополнительно, с целью уточнения особенностей течения и характера поражения сосудов, могут быть назначены следующие виды обследования:
• дуплексное сканирование вен,
• доплеровское исследование,
• венография,
• посев крови на стерильность при подозрении инфицирования.
Целью лечения при поверхностном тромбофлебите является достижение следующих задач:
1. Уменьшение боли.
2. Снятие воспаления.
3. Устранение причины, вызвавшей тромбофлебит (например, снять венозный катетер).
Если тромбофлебит вызван использованием цитостатиков, то в большинстве случаев можно обойтись местного лечения, включающего следующие пункты:
1. Придание конечности функционального покоя. При развитии тромбофлебита сосудов верхней конечности постельный режим не соблюдают и эластическими бинтами не пользуются. Если же тромбофлебит развился на нижней конечности, то ей придают возвышенное положение, а вопрос о применении компрессионного белья в данном случае решается индивидуально.
2. Препараты для местного лечения:
• спиртовые компрессы,
• мази, содержащие гепарин (например, лиотон-гель),
• мази, в состав которых входят НПВС (индометациновая мазь, индовазин, гель с диклофенаком и т. п.),
• мази, гели, содержащие троксевазин, рутозид.
Общее лечение основано на использовании нестероидных противовоспалительных средств, которые не только уменьшают боль, но и снимают воспаление. При повышенном риске тромбообразования назначают антикоагулянты сначала внутривенно (низкомолекулярные гепарины), затем внутрь в течение нескольких месяцев. Во время лечения антикоагулянтами нужно регулярно сдавать кровь на анализ и следить за симптомами возможного появления кровотечения (покраснение мочи, кровоточивость десен, черный стул, носовые кровотечения).
Если поверхностный тромбофлебит сочетается с образование тромбов в системе глубоких вен, то назначаются тромболитические лекарственные средства, а при появлении признаков инфекции — антибиотики.
Хирургическое лечение
Если тромбофлебит обусловлен введением химиотерапевтических препаратов, то оперативные вмешательства проводятся очень редко.
Иногда тромбы с поверхностных вен удаляют через проколы с последующим наложением компрессионного бандажа.
При развитии тромбофлебита в большой подкожной бедренной вене, тромб может распространиться и на глубокие вены. Такой тромб может отрываться и вызвать эмболию, в этом случае прибегают к операции.
Как правило, поверхностный тромбофлебит после химиотерапии — это краткосрочное событие, редко сопровождающееся осложнениями. В типичной ситуации все симптомы воспаления вен проходят за 1-2 недели, хотя пигментация кожи или уплотнение вен могут сохраняться достаточно длительное время.
Возможные осложнения
Как уже говорилось, осложнения при поверхностном тромбофлебите возникают крайне редко. Конечно, всегда вызывает настороженность появление тромба в сосуде, так как риск тромбоэмболии увеличивается. Однако при поверхностном тромбофлебите, в отличие от глубокого, тромбы отрываются крайне редко, так как в результате острой воспалительной реакции тромб как бы припаивается к стенке вены и вероятность его отрыва значительно уменьшается.
Кроме того, поверхностные вены не окружены мышцами так, как глубокие, поэтому сокращения мышц не приводят к сжатию, отрыву и смещению тромба.
Осложнения поверхностного тромбофлебита:
• инфекции,
• сепсис,
• тромбоз глубоких вен,
• гангрена,
• развитие тромбоэмболии легочной артерии.
Профилактика
Основным способом профилактики развития тромбофлебита при химиотерапии — это регулярная смена мест, используемых для введения препаратов, в том числе и при постановке катетера.
Так как одним из основополагающих факторов при развитии тромбофлебита является ограничение движений, то необходимо следить за тем, чтобы сохранять необходимый объем движений в верхней или нижней конечности.
Осложнения лучевой и химиотерапии онкологических заболеваний: ИБС, инсульт, венозная тромбоэмболия, тромбоэмболия при ФП (фрагмент программного документа Европейского общества кардиологов по кардиотоксичным осложнениям лечения онкозаболеваний, 2016г.)
Ишемическая болезнь сердца
Ишемия миокарда, реже — инфаркт миокарда или аритмии, индуцированные ишемией, являются побочными эффектами ряда методов лечения онкозаболеваний. В основе этих осложнений лежит целый спектр механизмов: от прямого индуцирования вазоспазма, эндотелиального повреждения и развития артериального тромбоза до долгосрочных изменений метаболизма липидов и, соответственно, преждевременного развития атеросклероза (таблица 1). Лучевая терапия на область средостения может усугублять поражение коронарных артерий, вызванное химиопрепаратами.
Таблица 1. Патофизиологические механизмы развития ИБС на фоне лечения онкозаболеваний.
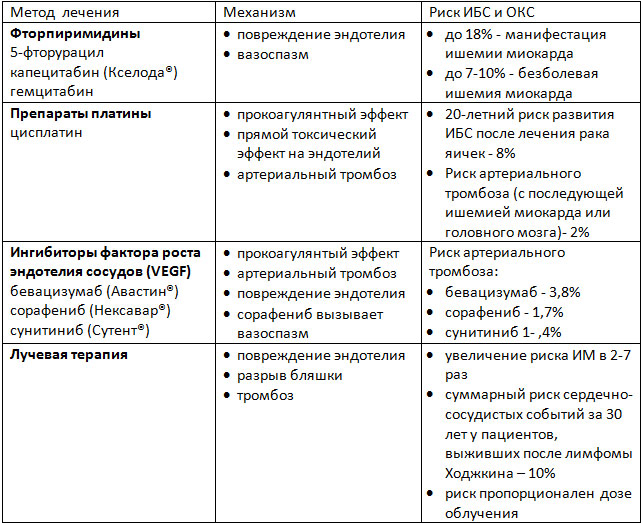
Фторпиримидины (такие как 5-фторурацил и его пероральная форма капецитабин) используются для лечения онкозаболеваний ЖКТ и некоторых других локализаций. Риск развития ишемии миокарда зависит от дозы, пути введения и схемы химиотерапии. Боль в груди и изменения ЭКГ чаще возникают в покое в дни введения химиопрепарата. Иногда проявления ишемии сохраняются после отмены препаратов. Проблема ишемии миокарда, индуцированной фторпиримидинами, может быть недооценена клинически. Последние исследования показали, что у 5-6% пациентов, получавших 5-ФУ, при стресс-тестах выявлялась безболевая ишемия миокарда. Также применение 5-ФУ может приводить к развитию острого ИМ. Пациентам, получающим эти препараты, следует регулярно выполнять ЭКГ. При выявлении признаков ишемии миокарда следует прерывать терапию.
Иммунная и таргетная химиотерапия
Препараты этих групп, воздействующие на сигнальные пути фактора роста эндотелия сосудов (VEGF), увеличивают риск коронарного тромбоза. Эти сигнальные пути важны для поддержания жизнеспособности клеток эндотелия, а ингибирование этих путей приводит к повреждению клеток эндотелия и их гибели. Риск тромбоза зависит от исходного заболевания и конкретного препарата. Так, для моноклонального антитела к рецептору VEGF бевацизумаба, риск составляет менее 1% при адьювантной терапии рака молочной железы, а при лечении метастатических форм онкозаболеваний – 3,8%.
Наддиафрагмальная (а при некоторых заболеваниях и поддиафрагмальная) лучевая терапия ассоциируется с высоким риском развития ИБС как за счет агрессивного течения атеросклероза, так и за счет других процессов, приводящих к разрывам бляшек и тромбозу коронарных артерий, а также, возможно, и за счет коронарного спазма. Для атеросклероза, вызванного лучевой терапией, характерно устьевое поражение коронарных артерий. Чаще всего затрагиваются передняя нисходящая артерия (при облучении левой молочной железы) и ствол левой коронарной артерии (при лечении лимфомы Ходжкина). Есть данные, что у женщин, которым проводилась лучевая терапия по поводу рака левой молочной железы, частота положительных стресс -тестов достоверно выше, чем у получавших лечение по поводу рака правой молочной железы.
Манифестация ИБС может быть быстрой (первое проявление болезни – ОКС или внезапная смерть), но чаще эффект бывает отсроченным. Например, изменения после лечения лимфомы чаще манифестируют через 15-20 лет (причем, молодые пациенты более восприимчивы к такому воздействию). Пациенты, выжившие после лечения лимфомы Ходжкина, характеризуются риском ИБС в 4-7 раз большим, чем вся популяция. Через 40 лет после лечения у 50% пациентов диагностируется ИБС.
Исходя из этих данных, оправдано проводить регулярное скрининговое обследование всех пациентов, которым проводилась лучевая терапия соответствующей локализации, начиная с момента 10-15 лет после лечения и далее пожизненно.
Дополнительными факторами риска возникновения или осложнений ИБС в результате лучевой терапии являются сопутствующий прием антрациклинов, молодой возраст, высокие дозы облучения (>30 Грей), отсутствие экранирования грудной клетки, классические факторы риска сердечно-сосудистых заболеваний и предсуществующая ИБС.
Внезапная сердечная смерть — явление, описанное у пациентов, подвергавшихся облучению. Связано оно было с диффузной гиперплазией интимы всех коронарных артерий или с гемодинамически значимым поражением ствола ЛКА.
Для предотвращения поражения сердца должны быть использованы такие методы, как максимально возможное снижение дозы облучения, тангенциальные поля облучения, экранирование структур сердца. В настоящее время существуют технологии, основанные на 3D планировании полей облучения с построением гистограмм доза-объем, а также различные симмуляционные программы. С помощью результатов КТ или МРТ можно достаточно точно идентифицировать контуры опухоли, а специальные программы рассчитывают распределение облучения.
Особенности диагностики и лечения
Перед началом химиотерапии или лучевой терапии важно выявить ИБС или другие сердечно-сосудистые заболевания, поскольку их исходное наличие значительно повышает риск дальнейших осложнений лечения онкозаболеваний.
Часто на фоне химио- и лучевой терапии развивается тромбоцитопения, поэтому лечение симптомной ИБС и ОКС крайне затруднено. Вообще, применение антитромботической терапии у получающих химио- или лучевую терапию часто противопоказано или очень ограничено. Пациентам, которым выполняется ЧКВ, необходимо использовать двойную антитромбоцитарную терапию как можно меньше по времени для минимизации риска кровотечений.
Клиника ИБС часто носит атипичный характер, зачастую развивается безболевая ишемия миокарда (за счет нейротоксических эффектов лучевой и химиотерапии).
В случае развития вазоспазма на фоне химиотерапии следует сменить используемый препарат. Если иных вариантов нет, продолжать терапию следует на фоне профилактического введения нитратов и/или антагонистов кальция под тщательным контролем.
В случае развития любых осложнений химио- и лучевой терапии со стороны сердечно-сосудистой системы пациенты подлежат длительному наблюдению кардиологом.
Тромбоэмболические осложнения фибрилляции предсердий
Для оптимизации антитромботической профилактики у пациентов с ФП обычно используют шкалы CHA2DS2-VASc и HAS-BLED. Однако обе эти шкалы не валидизировались у пациентов с онкозаболеваниями. У пациентов с онкозаболеваниями повышен риск как тромбоэмболических осложнений, так и кровотечений. Поэтому принятие решения о назначении антитромботической терапии может быть достаточно сложным и отличаться от общей популяции. Пациентам со значением CHA2DS2-VASc≥2 антикоагулянты могут быть назначены при числе тромбоцитов более 50 тыс/мкл (как правило, речь идет об АВК при условии хорошего контроля МНО – время пребывания в терапевтическом диапазоне МНО > 70%). В случае формально низкого риска ТЭО в соответствии со значениями CHA2DS2-VASc антикоагулянты все равно могут быть назначены, принимая во внимание риск венозной тромбоэмболии.
НМГ назначают в качестве краткосрочного лечения, либо как альтернатива варфарину у пациентов с высоким риском кровотечений или метастатическим поражением.
Данные по НОАК пока относительно ограничены. Кроме того, в исследования этих препаратов не включались пациенты с уровнем тромбоцитов менее 100 тыс/мкл. Однако мета-анализ исследований НОАК показал, что эти препараты безопасны для пациентов с онкозаболеваниями.
Артериальные тромбозы достаточно редки у пациентов с онкозаболеваниями (около 1%). Чаще они развиваются у пациентов с метастазирующим раком поджелудочной железы, молочной железы, колоректальным раком или раком легких, а также у пациентов, получающих антрациклины, таксаны, химиопрепараты на основе платины, а также ингибиторы VEGF. Чаще всего речь идет о пациентах с неблагоприятным прогнозом. Протромботический статус может увеличивать риск ТЭО у пациентов с ФП.
У пациентов с раком молочных желез, получающих гормональную терапию, риск артериальных тромбозов выше у использующих ингибиторы ароматаз по сравнению с тамоксифеном (по- видимому, за счет несколько более благоприятного влияния тамоксифена на липидный профиль).
Особенности лечения артериальных тромбозов у онкологических пациентов плохо изучены.
В случае повторных эпизодов артериальных тромбозов следует исключить наличие антител к фосфолипидам.
Венозный тромбоз и тромбоэмболия развиваются у 20% госпитализированных больных с раком (причем часто эти осложнения остаются не диагностированными). Помимо собственного влияния онкозаболевания, риск ВТЭО может повышаться на фоне химиотерапии (в том числе, с учетом использования неудаляемых венозных катетеров). Антитромботическая профилактика должна проводиться минимум в течение 4 недель после оперативного лечения.
У амбулаторных пациентов с раком мочевого пузыря, толстой кишки, яичников, легких, желудка и поджелудочной железы, получающих химиотерапию, риск ВТЭО также повышен, но целесообразность медикаментозной профилактики у таких пациентов неясна.
Таблица 2. Факторы риска венозной тромбоэмболии у онкологических пациентов.

Химиотерапия в комбинации с ингибиторами VEGF повышает риск ВТЭО в 6 раз, повторных ВТЭО – в 2 раза.
Выявление тромботических эпизодов в первую очередь основывается на наличии соответствующих симптомов. Ни одна из стратегий скрининга тромботических осложнений себя не оправдала. Часто при визуализации очага поражения находками являются бессимптомные тромбозы и даже ТЭЛА. Оптимальная стратегия лечения в этом случае не ясна, однако с целью профилактики повторных эпизодов такие тромбозы лечат как обычные.
Для лечения подтвержденного острого эпизода ВТЭО у гемодинамически стабильных пациентов следует назначать НМГ на 3-6 месяцев (такая терапия эффективнее варфарина при сходной частоте кровотечений и смертности). Риск геморрагических осложнений на фоне антикоагулянтной терапии ВТЭО у онкологических пациентов в 6 раз выше в сравнении с обычными пациентами с ВТЭО.
Онкозаболевания значительно повышают риск повторных ВТЭО, поэтому после окончания периода первоначального лечения антикоагулянтами следует оценить возможность назначения антикоагулянтной профилактической терапии (до того момента, когда рак будет считаться «вылеченным»).
Данные по НОАК у этой категории больных ограничены анализом в подгруппах в исследованиях, сравнивающих НОАК и варфарин (не было получено данных о различиях по частоте повторных ВТЭО и кровотечений). С НМГ НОАК не сравнивались. Разные НОАК могут отличаться между собой в связи с лекарственными взаимодействиями и разной чувствительностью к почечной и печеночной дисфункции.
Если повторное ВТЭО произошло на фоне антикоагулянтов, следует изменить терапию (перейти с АВК на НМГ, если пациент уже получает НМГ – увеличить дозу).
На настоящий момент нет четких доказательств целесообразности проведения тромболизиса в случае развития ТЭЛА с гемодинамической нестабильностью у этой категории пациентов, что связано со значительно повышенным риском кровотечений. Однако в ряде случаев (ориентируясь на ожидаемую продолжительность жизни) тромболизис может быть выполнен, принимая во внимание высокую смертность от такого типа ТЭЛА. Важно помнить о противопоказаниях к тромболизису у пациентов с опухолями ГМ и метастазами в ГМ. Также может быть выполнена хирургическая эмболэктомия, однако смертность во время этого вмешательства достаточно высока, и кардиопульмональное шунтирование требует агрессивной антикоагуляции.
Что касается профилактики ВТЭО у пациентов на химиотерапии, в настоящее время рекомендовано проводить медикаментозную профилактику (преимущественно, НМГ) амбулаторным пациентам с высоким риском ВТЭО (например, получающим анти-ангиогенные препараты по поводу множественной миеломы, либо химиотерапию по поводу местнораспространенного или метастатического рака поджелудочной железы или легких), но без высокого риска кровотечений.
У пациентов с центральным венозным катетером показано использование гепарина или АВК (причем применение гепарина ассоциировано с большей частотой тромбоцитопении и бессимптомных тромбозов глубоких вен).
Атеросклероз периферических артерий и инсульт
Тяжелое атеросклеротическое и неатеросклеротическое поражение артерий нижних конечностей может развиться у пациентов (до 30%), получающих нилотиниб, понатиниб или ингибиторы тирозин-киназы BCR-ABL (например, для лечения миелоидного лейкоза). Поражение может развиться даже в отсутствие факторов риска АПАНК, а в присутствии таких факторов риск поражения артерий нижних конечностей еще увеличивается. Поражение может развиться как в первый месяц терапии, так и отсрочено, в том числе – годы спустя после лечения. Ряд химиопрепаратов (например, L-аспарагиназа, цисплатин, метотрексат, 5-фторурацил и паклитаксел) может вызывать феномен Рейно.
Риск инсульта повышается (по меньшей мере, вдвое) после лучевой терапии на область средостения, шеи или головы. Происходит повреждение и тромбоз малых сосудов головного мозга. В сосудах среднего и крупного калибра описаны три патофизиологических механизма, повышающих риск инсульта – окклюзия vasa vasorum с последующим медианекрозом и фиброзом, фиброз адвентиции, а также прогрессирование атеросклероза (чаще развивается более чес через 10 лет после лучевой терапии). Похожие механизмы повреждения описаны для аорты и других периферических сосудов (включая подключичные и подвздошно-бедренные артерии, что приводит к ишемии конечностей).
Пациентам, которым проводилась лучевая терапия на область шеи или головы, а также лечение лимфомы, должно выполняться ультразвуковое исследование церебральных сосудов (особенно начиная с периода 5 лет после лучевой терапии). Исследование должно повторяться каждые 5 лет (или чаще, если при первом исследовании были обнаружены отклонения). Признаки постлучевых поражений других артерий выявляют при физикальном осмотре или по наличию соответствующих симптомов.
Jose Luis Zamorano, Patrizio Lancellotti, Daniel Rodriguez Muñoz, et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines. European Heart Journal (2016) 37, 2768–2801.
http://eurheartj.oxfordjournals.org/content/ehj/37/36/2768.full.pdf
Материал подготовлен сотрудником лаборатории клинических проблем атеротромбоза отдела ангиологии РКНПК им. А.Л. Мясникова к.м.н. Шахматовой О.О.
Лечебная тактика при тромбозе глубоких вен нижних конечностей
Опубликовано: ФЛЕБОЛОГИЯ, 4, 2015, выпуск 2
Общие подходык лечению тробоза глубоких вен нижних конечностей
• Амбулаторное лечение возможно в случаях неэмбо-лоопасного тромбоза с локализацией не выше паховой складки у пациентов без тяжелой сопутствующей патоло-гии, социально благополучных при условии проведения им адекватной антикоагулянтной терапии и наличии воз-можностей динамического врачебного, инструменталь-ного и лабораторного контроля.
• Доказана необходимость адекватной антикоагу-лянтной терапии как основы лечения больных с ТГВ (в том числе бессимптомного).
• Антикоагулянтная терапия при обоснованном по-дозрении на ТГВ должна быть начата до инструменталь-ной верификации диагноза.
• Подходы к использованию антикоагулянтов при ТГВ нижних и верхних конечностей одинаковы.
• Всем больным с ТГВ нижних конечностей показана эластичная компрессия.
• Эксперты считают неоправданным рутинное ис-пользование мер хирургической профилактики ТЭЛА, в том числе имплантации кава-фильтра. Они могут быть рассмотрены при невозможности применения адекват-ных доз антикоагулянтов из-за высокого риска геморра-гических осложнений, возникновении ВТЭО на фоне адекватного лечения антикоагулянтами, распространен-ном эмболоопасном тромбозе бедренного и/или илиока-вального сегментов, рецидивирующей массивной ТЭЛА со значительным остаточным перфузионным дефицитом.
• Российские эксперты не рекомендуют широкое ис-пользование регионарной тромболитической терапии.
Исключением является проведение тромболитической терапии при первичном тромбозе подключичной вены (болезнь Педжета—Шреттера).
Консервативное лечение
Режим. До инструментального обследования больным с ТГВ должен быть предписан строгий постельный режим для снижения риска ТЭЛА. После обследования пациенты с окклюзивными и пристеночными формами венозного тромбоза сразу могут быть активизированы.
Эластичная компрессия. Пациентам с ТГВ показано ношение компрессионного трикотажа 2–3-го класса. Когда отек нестабилен (т. е. объем конечности имеет зна-чительную суточную динамику), допустимо использова-ние эластичных бинтов длинной растяжимости. Эластич-ная компрессия противопоказана при хронических обли-терирующих заболеваниях артерий нижних конечностей, когда систолическое давление на задней большеберцовой артерии ниже 80 мм рт. ст. , дерматите и экземе различного происхождения.
Антикоагулянтная терапия показана всем больным с ТГВ при отсутствии противопоказаний. Лечение должно осуществляться терапевтическими дозами НФГ, НМГ, фондапаринукса натрия, АВК, НОАК (апиксабана, даби-гатрана этексилата, ривароксабана). Первоначально возможно парентеральное введение лечебных доз НФГ, НМГ или фондапаринукса натрия. В большинстве случаев следует предпочесть НМГ или фондапаринукс натрия. Внутривенную инфузию НФГ не-обходимо применять, когда предполагается проведение тромболитической терапии или хирургического лечения, при тяжелой почечной недостаточности (клиренс креати-нина ниже 30 мл/мин) и других свидетельствах высокого риска серьезных кровотечений, а также у больных с вы-раженным ожирением. Контроль адекватности антикоа-гулянтной терапии осуществляется с помощью монито-рирования АЧТВ (для НФГ), в ряде случаев анти-Ха-активности при использовании НМГ (у беременных, лиц с малой и избыточной массой тела, с почечной недоста-точностью). Изучаются возможности теста на тромбоди-намику. Косвенным нструментальным подтверждением эффективности антикоагулянтной терапии может слу-жить ультразвуковое ангиосканирование (отсутствие рас-пространения тромбоза).
В последующем для длительного лечения следует выбрать один из следующих режимов антикоагуляции:
— Переход с парентерального введения лечебных доз антикоагулянтов на АВК при целевом МНО 2, 0—3, 0. При этом длительность совместного применения АВК и парентеральных антикоагулянтов должна составлять как минимум 5 сут. Парентеральное введение лечебных доз антикоагулянтов может быть прекращено, когда при двух последовательных определениях с интервалом 1 сут МНО будет находиться как минимум на нижней границе терапевтического диапазона (не менее 2, 0).
— Переход на пероральный прием лечебной дозы да-бигатрана этексилата (150 мг 2 раза в сутки) как минимум после 5-дневного парентерального введения антикоагулянтов.
Альтернативой парентеральным антикоагулянтам служит пероральный прием лечебных доз апиксабана (10 мг 2 раза в сутки 7 дней, затем 5 мг 2 раза в сутки) или ривароксабана (15 мг 2 раза в сутки в течение 3 нед с пере-ходом на однократный прием 20 мг в сутки) с первого дня лечения ТГВ или переход на эти лекарственные средства в первые 2 сут после начатого введения парентеральных антикоагулянтов.
НОАК сопоставимы по эффективности с подходом, когда первоначально парентерально вводятся антикоагу-лянты и затем переходят на пероральный прием антагони-ста витамина К. При этом применение НОАК сопряжено с меньшим риском клинически значимых кровотечений. НОАК противопоказаны при тяжелой почечной недоста-точности и не изучены при использовании тромболитиче-ской терапии, хирургическом лечении ВТЭО, установке кава-фильтра. Продленное использование НМГ (подкожное введе-ние лечебной дозы в первый месяц с возможностью по-следующего снижения до 75% от лечебной) рекомендует-ся предпочесть у беременных, а также у больных со злока-чественными новообразованиями (по крайней мере, в ближайшие 3—6 мес после развития тромбоза). Общая продолжительность лечения антикоагулянта-ми зависит от наличия и характера факторов, предраспо-лагающих к рецидиву заболевания, наличия ВТЭО в анам-незе, распространенности тромбоза и ряда других обстоя-тельств (табл. 5). Она должна составлять не менее 3—6 мес. В случае индивидуальной непереносимости всех ан-тикоагулянтов, а также если больной отказывается про-должать антикоагулянтную терапию, вместо прекраще-ния антитромботической терапии для длительной вто-ричной профилактики ВТЭО можно рассмотреть прием ацетилсалициловой кислоты в дозе 100 мг 1 раз в сутки. Нецелесообразно использование в комплексном ле-чении ТГВ антибактериальных препаратов при отсут-ствии признаков системной воспалительной реакции.
Длительность лечения антикоагулянтами после эпизода ТГВ/ТЭЛА
Первый эпизод, сопряженный с обратимым фактором риска (травма, операция, острое нехирургическое заболевание) ТГВ: 3 мес при дистальной локализации тромбоза (голень) ; при обширном проксимальном тромбозе желательно продлить до 6 мес.
ТЭЛА: не менее 3 мес
Впервые возникший неспровоцированный эпизод Не менее 3 мес; продление на неопределенно долгий срок при проксимальном ТГВ и/или ТЭЛА, низком риске кровотечения и
возможности поддерживать стабильный уровень антикоагуляции*
Рецидивирующий ТГВ/ТЭЛА Неопределенно долго
Имплантация кава-фильтра Неопределенно долго
Злокачественное новообразование НМГ на 3–6 мес; в дальнейшем продление использования антико-агулянтов на неопределенно долгий срок или по крайней мере до излечения онкологического заболевания
Примечание. * — основания для продления антикоагулянтной терапии после впервые возникшего неспровоцированного эпизода проксимального ТГВ/ТЭЛА:
— тромбофилии, сопряженные с наиболее высоким риском рецидива ВТЭО (антифосфолипидный синдром, дефицит антикоагулянт-ных протеинов C или S, мутации фактора V Лейдена или протромбина G20210A) ;
— плохая реканализация проксимальных сегментов глубокого венозного русла по данным компрессионной ультрасонографии через 3 мес от начала лечения (данный фактор через 6 мес можно не учитывать) ;
— сохранение дисфункции правого желудочка по данным ЭхоКГ при выписке из стационара;
— повышенный уровень D-димера на фоне использования антикоагулянтов или его повышение через 1 мес после отмены антикоагулянтов.
Источники: http://www.onkodoktor.ru/razvitie-tromboflebita-posle-himioterapii, http://www.noat.ru/Go/ViewPage/id=167, http://volynka.ru/Articles/Text/1213