Тромбоз глубоких вен в анамнезе
Тромбоз глубоких вен нижних конечностей. Клинический случай

Christopher J. Gibson, M. D., Kathryn A. Britton, M. D., M.P.H., Amy Leigh Miller, M. D.,
Ph. D., Joseph Loscalzo, M. D., Ph. D., Тhe Department of Medicine,
Brigham and Women’s Hospital and Harvard Medical School, Boston
В данной статье вниманию читателя представлен реальный клинический случай: последовательно изложены этапы диагностики и лечения пациента (жирный шрифт), каждый из которых сопровождают комментарии и рекомендации клинического специалиста (обычный шрифт).
55-летний пациент с сердечной недостаточностью в анамнезе поступил в отделение неотложной помощи с отеком и болью в правой ноге. За три дня до обращения в больницу у пациента внезапно начался отек правой ступни и икры без какой-либо предшествующей травмы. Состояние ухудшалось, отек распространился на верхнюю часть ноги и сопровождался болью в ступне и икре. Больной удвоил обычную дозу торасемида, но эффекта от препарата не было. В день поступления в больницу он заметил, что кожа на пальцах правой ступни потемнела.
Хотя дифференциальная диагностика отека нижних конечностей широка, два признака, появившиеся в данном случае, помогают сузить круг возможных заболеваний: острое начало и асимметричность отека. Как правило, если ранее не было асимметричной венозной недостаточности, то отеки, возникающие из-за сердечной недостаточности, симметричны. Лимфедема или компрессия венозной или лимфатической системы могут быть причинами асимметричного отека, но в таких случаях для отека характерно подострое течение. Причиной острого отека и боли может быть разрыв кисты Бейкера, растяжение или разрыв мышц, тромбоз глубоких вен. В данном случае локализация отека не соответствует таковой при кисте Бейкера, которая обычно проявляется как болезненность, повышение температуры и покраснение кожи в области подколенной ямки и икры. У пациента в анамнезе не было травмы или повреждения, которые могли бы указать, что в основе возникновения заболевания лежит нарушение работы опорно-двигательного аппарата. Весьма вероятным является тромбоз глубоких вен, хотя изменение цвета пальцев не характерно для этого состояния и требует дальнейшего изучения.
В истории болезни пациента присутствовали ожирение, пароксизмальная форма фибрилляции предсердий, гипертензия и сердечная недостаточность с сохранением фракции выброса. Лекарственная терапия включала варфарин, соталол, торасемид и лизиноприл. Личного или семейного анамнеза тромбоза вен или артерий не было. Пациент курил в течение 30 лет, но бросил курить 5 лет назад; выпивал около 4 бутылок пива каждые выходные. Он сообщил, что целенаправленно снижал вес: за последние 6 мес. похудел на 22,7 кг; этот результат больной приписывал сочетанию диеты и физических упражнений.
Развитие тромбоза глубоких вен у пациента, принимающего варфарин, предполагает субтерапевтическое МНО или состояние гиперкоагуляции. У пациента нет однозначных факторов риска тромбоза глубоких вен, таких как послеоперационное состояние, недавняя иммобилизация или выявленный рак, а также личного или семейного анамнеза венозной тромбоэмболии. Однако его резкое похудение, которого было бы трудно добиться даже при радикальной диете и интенсивных физических упражнениях, ставит вопрос о невыявленном раке, который мог привести к состоянию гиперкоагуляции.

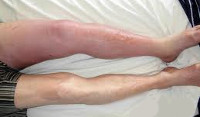
При физическом осмотре были получены следующие сведения: температура 36,1 °C, частота сердечных сокращений (ЧСС) 80 уд./мин. и артериальное давление 95/50 мм рт. ст.; насыщение кислородом при вдыхании воздуха составляло 95 %. При осмотре ротоглотки было отмечено неправильное расположение зубов. Билатеральная аускультация показала, что легкие чистые. Сердечный тон регулярный с нормальным первым тоном (S1), физиологически расщепленным вторым тоном (S2), без шумов, помех или галопа. Давление в яремной вене — 8 см водн. ст. Живот тучный, мягкий, без вздутия, с нормальными звуками кишечника, без гепатоспленомегалии. Ноги заметно асимметричны, с отеками в верхней части правого бедра (степень выраженности 4+) и в левой икре (степень выраженности 2+). Правая нога и ступня потемневшие и холодные, периферический пульс был обнаружен только при допплеровской ультрасонографии. На правой щиколотке и подошве правой ступни были отдельные геморрагические пузыри, багровые, более темные в центре (рис. 1). Пузыри сливались в верхней и средней части стопы и пальцев. Вся правая нога отечная, но без экзематозных изменений или шелушения. Пурпуры, кроме как связанной с буллезным поражением, не было. Пульс в левой ноге легко прощупывался, отека не было. Мышечный тонус и сила, ощущения от укола и легкого прикосновения были интактны и одинаковы для обеих ног.
Триада симптомов, включающая асимметричный отек ног, цианоз и боль, сильно напоминает синюю болевую флегмазию — редкий синдром, встречающийся в случаях массивного тромбоза проксимальных вен, который в достаточно тяжелых случаях вызывает артериальную недостаточность. В данном случае боль в состоянии покоя, холодные ноги и ступни, цианоз и отсутствие пальпируемого пульса свидетельствуют, что артериальная недостаточность уже возникла. Артериальная недостаточность также может развиться из-за эмболизации артериальных сосудов. Хотя пациент имеет факторы риска артериальной эмболизации (фибрилляция предсердий), ишемия конечностей вследствие артериальной эмболизации не связана с отеком. Прогрессирующий отек конечности, предшествующий артериальной недостаточности, как в этом случае, позволяет предположить первичный тромбоз вен с вторичной артериальной недостаточностью.
Синяя болевая флегмазия (циркуляторная венозная гангрена), как и другие причины острой ишемии конечностей, требует неотложной медицинской помощи, т. к. длительная ишемия тканей может поставить под угрозу жизнеспособность конечности. Нога должна быть немедленно поднята. Необходимы немедленное обследование и начало лечения. Артериальное давление 95/50 мм рт. ст., которое кажется значительно ниже, чем исходное давление у пациента, обусловленное его гипертензией, — это повод для беспокойства. Вследствие потери внутрисосудистой жидкости в интерстициальной ткани может развиться гиповолемический шок. Высвобождение медиаторов воспаления также может привести к вазодилатации. Обязательна реанимация. В данном случае отсутствие тахикардии не следует считать обнадеживающим признаком, т. к. ЧСС пациента может быть снижена вследствие приема соталола. Ожидая результатов дальнейшего обследования, следует начать антикоагуляционную терапию.
Хотя лечение должно быть сфокусировано непосредственно на устранении ишемии нижних конечностей, наличие синей болевой флегмазии позволяет предположить, что основная причина нарушения — рак. Необходимо срочно провести соответствующее клиническое обследование для выявления онкологической патологии, после того как состояние больного стабилизируется и он пройдет лечение ишемии конечностей.
Уровень натрия составлял 136 ммоль/л, калия — 4,6 ммоль/л, хлоридов — 110 ммоль/л, бикарбонатов — 23 ммоль/л; содержание азота мочевины в крови составляло 18 мг/дл (6,4 ммоль/л), уровень креатинина — 0,8 мг/дл (71 мкмоль/л). Уровень аланинаминотрансферазы был равен 31 Ед./л, аспартатаминотрансферазы — 34 Ед./л, уровень общего билирубина составлял 0,5 мг/дл (8,6 мкмоль/л), щелочной фосфатазы — 630 Ед./л (норма — 35–130 Ед./л), альбумина — 3,1 г/дл. Уровень лейкоцитов крови составлял 16900 Ед/мм 3 , из них 77 % нейтрофилов, 12 % лимфоцитов, 8 % моноцитов и 3 % эозинофилов. Гематокрит был 37,1 %, содержание тромбоцитов — 283000 Ед./мм 3 . Результат клинического анализа периферической крови на шистоциты был отрицательным. Протромбиновое время — 42,3 с (МНО 4,3), частичное тромбопластиновое время — 89 с (норма — 23,8–36,6 с); уровень фибриногена составлял 215 мг/дл (6,3 мкмоль/л) (норма — 200–450 мг/дл, 6–13 мкмоль/л). Ультрасонограмма правой ноги показала несжимаемость глубоких вен, полученные данные подтверждают диагноз тромбоза, распространившегося от общей бедренной вены до подколенной вены.
Тромбоз вен без очевидных причин и с учетом повышенного МНО позволяет предположить состояние гиперкоагуляции, которое, принимая во внимание возраст пациента, скорее всего, приобретенное, а не наследственное. У этого пациента рак рассматривается как основная причина гиперкоагуляции, которая обусловливает снижение массы тела и тесную связь между раком и синей болевой флегмазией. Значительное увеличение уровня щелочной фосфатазы может свидетельствовать о наличии опухолевого инфильтрата в печени или костях; измерение γ-глутамилтрансферазы может помочь дифференцировать эти состояния, т. к. его повышенный уровень позволяет предположить, что опухоль располагается в печени. Хотя прием варфарина — наиболее вероятная причина увеличения частичного тромбопластинового времени и протромбинового времени, следует также рассмотреть в качестве причины приобретенный ингибирующий фактор или диссеминированное внутрисосудистое свертывание крови с последующим истощением факторов свертывания в общем пути обмена. Однако нормальный уровень фибриногена и отсутствие шистоцитов делают диссеминированное внутрисосудистое свертывание крови менее вероятным. Повышение отношения содержания азота мочевины в крови к креатинину согласуется с преренальными причинами острой почечной недостаточности, отражающей массивную задержку жидкости, что обычно происходит при синей болевой флегмазии.

Несмотря на то, что значение МНО составляет 4,3, я бы предпочел начать лечение парентеральными антикоагулянтами и выбрал нефракционированный гепарин, а не низкомолекулярный гепарин, который обусловливает острое повреждение почек у пациента и возможную необходимость в интервенционном вмешательстве на венах. Также следует назначить витамин К, чтобы минимизировать риск кровотечения, которое может возникнуть в результате комбинированного применения терапевтического гепарина и субтерапевтического варфарина, и способствовать насыщению протеинами С и S, т. к. их функциональный дефицит может быть вызван приемом варфарина и может способствовать развитию гиперкоагуляции у пациента.
Кроме того, для восстановления перфузии, обусловленной тяжелой степенью ишемии конечностей, следует назначить инвазивную терапию (системный тромболизис, локальный катетерный тромболизис с/без механического тромболизиса, тромбэктомию). Быстрый и полный фибринолиз, достигнутый при инвазивной терапии, может увеличить шансы сохранить конечность, хотя и повышает риск кровотечения. В этом случае я бы выполнил катетерный тромболизис, т. к. эта процедура не требует общей анестезии и потенциально позволяет провести тромболизис и для больших, и для малых вен.
Был внутривенно введен витамин К, после чего МНО снизилось до 1,5. Была начата терапия нефракционированным гепарином внутривенно. При флебографии ног была обнаружена полная окклюзия общей бедренной вены, бедренной вены и подколенной вены (рис. 2А). После реолитической тромбэктомии большая тромбовая бляшка сохранилась, что подтолкнуло к проведению к катетер-управляемого тромболизиса с применением тканевого активатора плазминогена (ТАП). На следующий день при повторной флебографии было выявлено, что проходимость венозной системы восстановлена (рис. 2В). Катетер с ТАП был удален, возобновлена системная антикоагуляционная терапия. При лабораторном исследовании перед началом терапии гепарином были выявлены нормальный уровень гомоцистеина, нормальный результат оценки функционального антиромбина III и исследования сопротивления активированного протеина С. Результаты исследования для выявления мутации гена протромбина G20210A были отрицательными, антифосфолипидные антитела не обнаружены.
Т. к. несколько факторов позволяли предположить, что причиной гиперкоагуляции у пациента является рак, значение обследования на предмет наследственной тромбофилии невелико. Обследование должно быть направлено на выявление рака.
Уровень γ-глутамилтрансферазы составил 295 МЕ/л (норма — 0–40 МЕ/л). Компьютерная томография брюшной полости и малого таза без внутривенного введения контраста показала множественные гиподенсивные поражения печени до 3 см в диаметре. Наблюдалась обширная перипортальная и абдоминальная забрюшинная лимфаденопатия, а также диффузные уплотнения сальника и неравномерное утолщение на большой кривизне желудка (рис. 3).

Полученные данные позволяют предположить наличие метастатического рака, возможно, развившегося из первичного рака желудка, также возможна инфильтративная опухоль поджелудочной железы. Эти результаты подтверждают наше раннее подозрение, что причиной значительной потери веса и состояния гиперкоагуляции являлся рак, и, к сожалению, предвещают неблагоприятный прогноз.
Эндоскопия верхнего отдела ЖКТ и эндоскопическая ультрасонография позволили выявить обширное инфильтративное новообразование с центральным изъязвлением на большой кривизне желудка (рис. 4). Патологическое исследование биоптата, полученного при эндоскопии, выявило плохо дифференцируемую, инвазивную аденокарциному желудочного происхождения (рис. 5). Развились прогрессирующая гипотензия и почечная недостаточность, которые не отвечали на восстановление объема жидкости. Была начата терапия допамином и вазопрессином. Команда сосудистых хирургов рассматривала целесообразность ампутации правой ноги, но пациент отказался от этой процедуры, учитывая общий плохой прогноз. По требованию больного терапия вазопрессином была отменена, начато паллиативное лечение. Пациент умер через 10 дней после госпитализации.

Обсуждение
Врачам хорошо знакомы классические симптомы тромбоза глубоких вен: односторонняя боль, отек, повышение температуры, покраснение кожи, но в данном случае некоторые симптомы обширного тромбоза глубоких вен ног дают основания для отдельного обсуждения. Белая болевая флегмазия характеризуется обширным отеком всей ноги без ишемии тканей, т. к. сохраняется некоторый венозный отток с помощью поверхностных коллатеральных сосудов. В отличие от этого синяя болевая флегмазия возникает в связи с полной обструкцией поверхностных и глубоких вен. В результате развивается венозная гиперемия, которая приводит к увеличению нагрузки на малые артериолы и к ишемии тканей, характеризующейся появлением синюшных или темных пятен на коже и способной прогрессировать до очевидной гангрены.
Для клинической диагностики синей болевой флегмазии требуется распознать обширный тромбоз глубоких вен, а также признаки артериальной недостаточности, в том числе отсутствие пульса, боль, пойкилотермию (нарушение способности поддерживать постоянную температуру тела, в данном случае — холодные конечности) и паралич. В отличие от бледности, которая возникает в случае острого нарушения кровообращения (при артериальной эмболии), багрово-синий цианоз появляется из-за сопутствующей венозной гиперемии при синей болевой флегмазии. Это изменение цвета обычно начинается дистально, но может распространяться и проксимально, в зависимости от продолжительности и степени ишемии. Парестезии, мышечная слабость или оба эти симптома обычно предшествуют параличу, который развивается впоследствии.

Синюю болевую флегмазию, как и другие причины артериальной недостаточности, необходимо лечить безотлагательно. Поскольку это редкое явление, рекомендации для лечения данной патологии в большей степени основываются на опыте, полученном при изучении отдельных случаев. Согласно консенсусу экспертов, рекомендуется как можно раньше начать терапию с применением самых современных методик, направленных на реперфузию конечностей, особенно у пациентов с гангреной или угрозой ее развития, из-за высокого риска потери конечности. Как показывает данный пример, клиницисты должны быть осведомлены о серьезных системных проявлениях синей болевой флегмазии, в числе которых массивная задержка жидкости, высвобождение медиаторов воспаления через ишемизированные ткани и развивающаяся в результате этого гипотензия, шок. В редких случаях также может появиться синдром сдавления. В самых тяжелых случаях венозной гангрены может потребоваться ампутация конечности.
Хотя существует много общепризнанных причин развития тромбофилии, рак является наиболее распространенной причиной возникновения синей болевой флегмазии, что зафиксировано в ряде публикаций; другими факторами риска являются ожирение, пожилой возраст, иммобилизация. Данные регистра показывают, что некоторые виды рака имеют высокий тромбогенный риск: к ним относятся рак желудка, пищевода, легких, поджелудочной железы, почек, яичников, а также острый миелобластный лейкоз и неходжкинская лимфома. Риск венозной тромбоэмболии у онкологических пациентов в дальнейшем увеличивается из-за многочисленных сопутствующих факторов риска. Например, пациенты с онкопатологиями часто прикованы к постели, получают терапию препаратами, обладающими прокоагулиующим действием, часто им установлен постоянный венозный катетер, необходимы хирургические вмешательства. Онкологические пациенты, у которых развивается тромбоз, имеют худший прогноз, чем те, у которых тромбоза нет, что, возможно, отчасти связано со сходными механизмами развития тромбоза и предрасположенности к локальному или метастатическому распространению опухоли.
Кроме тромбоза глубоких вен, другие проявления связанной с раком гиперкоагуляции включают поверхностный мигрирующий тромбофлебит, диссеминированное внутрисосудистое свертывание, тромботическую микроангиопатию, артериальный тромбоз и токсический эндокардит. Хотя связь между раком и повышенной свертываемостью крови признана давно, патофизиология этого механизма еще не полностью понятна. Многие виды рака напрямую нарушают гомеостаз кровеносной системы, провоцируя активацию прокоагулянтных молекул в тканях носителя или экспрессируя прокоагулянтные молекулы на поверхности раковых клеток. Возможно, хорошим примером этого феномена являются микрочастицы опухоли, экспрессирующие тканевой фактор, который в комплексе с активированным фактором VII активизирует факторы IX и X. Эти микрочастицы были выявлены у пациентов с различными онкопатологиями на поздних стадиях, особенно у пациентов с раком поджелудочной железы. Наличие микрочастиц связано с повышенным риском тромбоэмболии, они исчезают из системы кровообращения при успешном лечении рака. К сожалению, исход заболевания в описанном в данной статье случае подчеркивает, что у пациентов с синей болевой флегмазией, ассоциированной с онкологическим заболеванием, плохой прогноз. Это заболевание связано с высоким уровнем смертности и риском развития осложнений даже при отсутствии рака; а при наличии и венозной тромбоэмболии, и онкологического заболевания состояние является в высшей степени угрожающим. Как показано в данном случае, рак, обнаруженный после эпизода венозной тромбоэмболии, связан с прогрессированием заболевания и имеет плохой прогноз.
Этот случай позволяет оценить, насколько значимо выявление редкой патологии (синей болевой флегмазии), которая требует оперативного лечения, чтобы минимизировать риск осложнений и смертности. Он также служит примером того, что при распознании отдельных клинических синдромов следует немедленно инициировать углубленное исследование для выявления лежащих в основе причин. В этом случае наличие многочисленных данных, свидетельствующих о невыявленном и агрессивном раке, включая наличие синей болевой флегмазии, привело к адекватной оценке целей терапии и оперативной диагностике лежащего в основе заболевания.
N Engl J Med 2014; 370:1742–1748 May 1, 2014DOI: 10.1056/NEJMcps1213589
Перевод с англ. Ольги Тачановской
Тромбоз глубоких вен
По существу для всех случаев ТЭЛА и тромбоза глубоких вен (ТГВ) характерно наличие определенных факторов риска: стаза венозной крови, повреждения интимы сосудов или гиперкоагуляции.
Первичная гиперкоагуляция часто не диагностируется. У молодых пациентов, больных, не имеющих других факторов риска или имеющих в личном или семейном анамнезе рецидивирующий тромбоз, следует исключать гиперкоагуляцию, связанную с болезнью V фактора Лейдена, антикардиолипиновыми антителами, гомоцистинурией, дефицитом антитромбина III или белков С или S (см. главу 30 «Нарушения свертывания крови и кровотечения. Антикоагулянтная терапия»).
Среди всех стационарных больных источником большинства (приблизительно 90 %) случаев ТЭЛА, как полагают, являются тромбы глубоких вен голени, которые распространяются выше колена. Тромбы, не выходящие за пределы голени, не имеют большого значения. К сожалению, приблизительно половина тромбов вен голени распространяется выше колена и примерно половина из них в конечном счете вызывает клинически значимую ТЭЛА. Следовательно, если не принять профилактические меры, у 10—20 % больных с тромбозом вен голени возникает ТЭЛА. Не у всех этих пациентов развиваются симптомы эмболии. Пациенты ОИТ отличаются тем, что у них часто имеются другие, «нетрадиционные» источники формирования эмбола. Длительное нахождение катетеров в венах обеспечивает постоянный очаг формирования тромба: эмболия с наибольшей вероятностью может возникнуть после удаления катетера, когда налипший тромб отрывается от его поверхности. Обработанные гепарином катетеры можно временно защитить от тромбоза, пока гепарин не будет смыт, т. е. в течение от 24 до 36 ч.
Поверхностный тромбофлебит, проявляющийся покраснением, болезненностью и нащупываемой уплотненной веной («венозным шнуром»), не несет в себе серьезной опасности эмболии, если он не захватывает систему глубоких вен. В последнем случае развивается общий отек одной конечности, что не характерно для поверхностного тромбофлебита.
Клиническое обследование обычно не позволяет обнаружить признаки ТГВ и отличить его от похожих состояний. Симптомы ТГВ выявляются при наличии воспаления и обструкции венозного оттока. Предположить ТГВ можно при гиперемии нижней конечности, повышении местной температуры, отечности и болях, а также при отеке лодыжки и области голеностопного сустава с одной стороны. К сожалению, воспаление или окклюзия могут отсутствовать или не проявиться, а описанные симптомы могут быть вызваны другими причинами, не связанными с тромбозом. При клиническом обследовании по крайней мере половина крупных внутрисосудистых тромбов остается незамеченной.
Симптом Хомена при воспалительных процессах в венах голени является неспецифическим признаком и редко встречается при установленном ТГВ.
Некоторые заболевания часто могут вызвать схожие с ТГВ симптомы. Разрыв кисты Бейкера у больных с ревматоидным артритом создает гиперемию, припухлость и болезненное уплотнение в икроножной области. Необходимо точно поставить диагноз, чтобы избежать применения неправильной и потенциально опасной терапии (например, использования тромболитических препаратов), которая могла бы вызывать кровотечение в кисту.
Разрыв сухожилия поверхностного сгибателя также может создать картину, напоминающую ТГВ, но распознать это повреждение помогает анамнез, вызывающий на недавнее растяжение с острым возникновением мучительных болей. Солевой артрит (подагра или псевдоподагра) иногда вызывают интенсивное воспаление суставов, которое распространяется на область икры. Часто принимают за ТГВ воспаление в подкожной клетчатке развивающееся в результате прямой травмы или хронического микоза нижних конечностей, а также после аортокоронарного шунтирования. Этот процесс иногда настолько трудно отличить от ТГВ, что до подтверждения диагноза ТГВ начинают терапию антибиотиками и гепарином ex vivantibus. У больных с гемофилией или у пациентов, получающих антикоагулянты, образование гематомы в икроножных мышцах порой также обусловливает клинические симптомы, схожие с ТГВ. Безболезненный отек икры возникает и после перенесенного глубокого флебита.
Несмотря на то, что большинство эмболов поступает из нижних конечностей, отсутствие визуально установленного диагноза ТГВ не исключает возможности легочной эмболии. При скрининговых исследованиях необтурирующие тромбы могут быть пропущены. Почти у одной трети больных с ангиографически доказанной ТЭЛА диагностическое изображение нижних конечностей дал отрицательные результаты (часто потому, что все поддающиеся обнаружению тромбы попали в сосуды легких). По этой причине отрицательные данные при исследовании вен нижних конечностей не могут служить доказательством отсутствия легочной эмболии.
Двойное ультразвуковое сканирование способно дать непосредственное изображение вен и определить скорость венозного кровотока. Если такое исследование визуализирует несжимаемый сгусток в просвете вены, диагноз подтверждается. Доплеровское исследование кровотока также точно идентифицирует окклюзию крупной вены, если кровоток не нарушен низким сердечным выбросом или центральной венозной перегрузкой. Поскольку допплерографии определяет признаки обструкции крупных вен, ультразвуковое исследование не столь чувствительно, как контрастная флебография или исследование с меченым фибриногеном, которые могут обнаружить тромбы в венах икры или необтурирующие тромбы в бедренных венах. Прогностическая ценность ультразвукового исследования у амбулаторных больных молодого возраста с подозрительными симптомами очень высока, однако этот метод менее чувствителен и специфичен, чем контрастная флебография, у больных в тяжелом состоянии. Тем не менее мобильность, низкая стоимость и полная безопасность делают ультразвуковое исследование методом выбора для пациентов ОИТ.
Импедансная плетизмография (реография) позволяет обнаружить наступившие изменения в электрическом сопротивлении нижней конечности при обструкции венозного кровотока и при его восстановлении. Если кровоток в крупных венах значительно затруднен, изменения реограммы носят более постепенный характер после его восстановления. ФИ остром ТГВ реография имеет такую же низкую частоту ложноположительных результатов, как ультразвуковое исследование. К сожалению, подобно ультразвуковому исследованию, реография не дает возможности надежно диагностировать тромбоз тазовых вен и вен икроножных мышц. Как и ультразвуковой метод, реография привлекательна своей мобильностью, низкой стоимостью и может повторяться ежедневно в случае, если необходимо обнаружить распространение тромба выше колена.
Контрастная флебография — наиболее чувствительный и определенный метод диагностики ТГВ, но она требует много времени и потенциально травматична.
К сожалению, сохраняющаяся проходимость вены не гарантирует, что эмболия не возникнет в будущем, что тромб, располагавшийся в просвете вены, не оторвался или не произошла его реканализация перед исследованием. Кроме того, введение контрастного вещества может способствовать почечной недостаточности, вызвать аллергические реакции и местный флебит. Флебографию наиболее разумно использовать с целью дифференцировать окклюзию крупной вены от воспаления подкожной клетчатки или других причин отека и воспаления в нижних конечностях. Радионуклидная флебография из-за своей низкой чувствительности и специфичности практически бесполезна.
Сканирование с использованием фибриногена, меченного радиоактивным йодом ( 1), является чувствительной методикой для обнаружения активного накопления фибриногена в венах голени. К сожалению, ее чувствительность уменьшается при терапии гепарином, такое исследование стоит дорого, а ответ можно получить лишь через 12—24 ч после введения индикатора. Такое сканирование далеко не всегда позволяет обнаружить тромбы в подвздошных или тазовых венах, поскольку в этих областях сигнал введенного индикатора слаб по сравнению с фоновым сигналом.
Из-за сопутствующих технических проблем риска инфицирования вирусным гепатитом этот метод в настоящее время применяется редко.
Самое важное в борьбе с ТГВ — первичная профилактика. В сущности предупреждение ТГВ имеет настолько большое значение, что имеет смысл проводить профилактические мероприятия практически всем пациентам ОИТ. Основной метод профилактики ТГВ — обеспечение ранней подвижности больных. Важно исключить чрезмерную седацию и излишнюю миорелаксацию, потому что оба воздействия продлевают период постельного режима. Ряду больных вполне можно проводить ИВЛ в амбулаторных условиях при помощи передвижных респираторов, хотя некоторые клиницисты считают это нереальным. Если ранний перевод больного на амбулаторное лечение невозможен, необходимо проводить механическую или фармакологическую профилактику ТГВ.
Хорошо подобранные эластичные чулки с градуированной компрессией и специальные последовательно надуваемые воздухом манжеты способны поддерживать венозный кровоток и уменьшать стаз у больных, которым противопоказано применение антикоагулянтов (например, после травмы, операций на сосудах или при коагулопатии). Показано, что применение только одного такого устройства любого типа уменьшает риск ТГВ, но когда используют вместе регулируемые компрессионные чулки и прерывистые нагнетательные компрессионные манжеты, частота развития ТГВ еще больше снижается. Вместе с тем представляется спорным, что эти механические устройства столь же действенны, как фармакологическая профилактика.
Профилактическое подкожное введение гепарина является высокоэффективным методом предотвращения ТГВ, но недостаточно для лечения уже существующего тромба. В отобранных группах больных гепарин уменьшает риск ТГВ на 50— 75 %, но полностью не устраняет опасности тромбоза или ТЭЛА. Подкожное введение постоянной дозы («мини-дозы») гепарина (5000 ЕД каждые 8—12 ч), по достоверным данным, оказывает благоприятное воздействие на больных терапевтического и общехирургического профиля, однако у пациентов, которым производят операции на бедре, коленном суставе или предстательной железе, результаты не столь успешны.
Для максимальной зашиты этим больным с высоким риском ТЭЛА требуется пероральный прием варфарина, а также введение гепарина в дозе, достаточной, чтобы увеличить частичное тромбопластиновое время (обычно 5000—10 000 единиц подкожно каждые 8—12 ч), или низкомолекулярного гепарина.
Терапия постоянными низкими дозами гепарина не способствует удлинению частичного тромбопластинового времени или вызывает геморрагические осложнения; может возникать и симптоматическая тромбоцитопения (см. главу 30 «Нарушения свертывания крови и кровотечения. Антикоагулянтная терапия»).
В некоторых исследованиях показано, что низкомолекулярный гепарин по своей эффективности равен обычному гепарину при профилактике ТГВ или превосходит его и при его применении геморрагические осложнения возникают реже. Также сообщается, что при ортопедических вмешательствах на нижних конечностях низкомолекулярный гепарин не менее эффективен, чем стандартный гепарин или варфарин. Снижение риска кровотечения, вероятно, является результатом менее интенсивного взаимодействия препарата с фактором фон Виллебранда, чем у традиционного, нефракционированного гепарина.
При некоторых ортопедических операциях (например, при протезировании тазобедренного или коленного суставов) предоперационное применение варфарина в низкой дозе уменьшает риск ТГВ и не увеличивает частоту геморрагических осложнений. Благодаря относительной длительности периода между началом терапии варфарином и получением защитного эффекта этот препарат особенно удобен при плановых, а не экстренных операциях. Декстран также уменьшает риск ТГВ, но часто дает побочные эффекты, включая усиление кровоточивости, и поэтому его применение ограничено.
Аспирин и дипиридамол, как показали исследования, не обладают такими же защитными свойствами, как варфарин или гепарин.
Целями терапии при ТГВ являются предотвращение увеличения тромба, -охранение строения вены и устранение боли. Однако даже оптимальная антикоагулянтная терапия не гарантирует, что у больных с имеющимся тромбозом глубоких вен не взовьется ТЭЛА. Она возникает почти у 15 % больных с ТГВ на фоне Идеальной антикоагулянтной терапии. Пациентам с ТГВ и активно продолжающимся тромбозом в начале лечения могут потребоваться большие дозы гепарина. Поскольку процесс тромбообразования угнетения в тромбе происходит эндогенный тромболизис, ежедневная потребность в гепарине обычно снижается. Невозможно точно предсказать поведение тромба или точную потребность в гепарине, хотя это предмет частых дискуссий. К счастью, поскольку лечение ТГВ и легочной эмболии по существу одинаково, диагноз одного из этих состояний устраняет необходимость устанавливать наличие второго.
В настоящее время постоянная инфузия гепарина остается стандартным методом лечения выявленного ТГВ, если нет противопоказаний к антикоагулянтам. Однако вполне вероятно, что периодическое введение фракционированного гепарина скоро заменит постоянную инфузию простого гепарина: оба метода одинаковы по эффективности, а периодическая терапия относительно проста в применении и потенциально дешевле. Целью постоянной инфузии гепарина является удлинение в полтора раза частичного тромбопластинового времени (ЧТВ) по сравнению с исходной величиной у данного больного. Величина ЧТВ, менее чем в 1,5 раза превышающая контрольную величину, указывает на вероятность рецидива тромбоза, однако поддерживать более интенсивную антикоагуляцию нецелесообразно.
Чрезмерное продление ЧТВ (более 100 с) может увеличивать риск кровотечения, но связь между ЧТВ и геморрагическими осложнениями остается спорной. В целом приблизительно у 1 % больных, получающих антикоагулянты, ежедневно возникают кровотечения, составляя 7— 15 % от всех случаев кровотечений во время осуществляемой в больнице противосвертывающей терапии. Спонтанное кровотечение бывает редко, если нет нарушений целостности сосудов, изменения функции тромбоцитов или значительной передозировки гепарина. Чаще всего кровотечения возникают у алкоголиков, престарелых пациентов, в послеоперационном периоде и у пациентов, получающих антиагреганты. Введение гепарина следует продолжать примерно пять дней до перехода на пероральные антикоагулянты, чтобы дождаться организации тромба и прикрепления его к стенке сосуда.
По сравнению с обычным гепарином низкомолекулярный гепарин имеет не меньшую эффективность при лечении развившегося ТГВ. Возможность безопасно периодически вводить низкомолекулярный гепарин подкожно без мониторинга ЧТВ дает надежду на снижение стоимости лечения и сокращение длительности пребывания в стационаре. Возможно, лечение неосложненных форм ТГВ станет полностью уделом поликлиники.
Менее выраженный эффект угнетения тромбоцитов может снизить риск геморрагических осложнений.
Варфарин следует назначать вскоре после начала введения гепарина, чтобы не прерывать антикоагулянтную терапию и сократить срок пребывания в стационаре. Удлинение протромбинового времени в 1,2—1,5 раза (международное нормализованное отношение [MHO] = 2—3) обычно предотвращает рецидив тромбоза, однако больным с наследственными или приобретенными коагулопатиями часто требуется более интенсивная антикоагулянтная терапия. Например, пациентам с синдромом антикардиолипиновых антител для эффективной профилактики бывает необходимо MHO выше 3. Прием варфарина, как правило, продолжают от 3 до 6 мес после не-осложненного эпизода ТГВ или до ликвидации факторов риска. При более коротких периодах антикоагулянтной терапии частота рецидивов возрастает, но опасность геморрагических осложнений снижается.
Продолжительность противосвертывающего лечения должна определяться индивидуально, с учетом соотношения между опасностью кровотечения и риском повторного тромбоза. Эпизоды рецидивирующего ТГВ с распространенным поражением нередко приходится лечить в течение более длительного времени.
У больных с ТГВ тромболитическая терапия уменьшает частоту развития постфлебитического синдрома, однако нет доказательств того что она снижает риск ТЭЛА или смерти. Из-за редко встречающегося, но крайне опасного осложнения в виде кровоизлияния в мозг при не-осложненном ТГВ тромболитическая терапия используется редко, при этом нет убедительных данных о преимуществах одного тромболитика над другим ни при ТГВ, ни при ТЭЛА.
Тромбоз глубоких вен
Тромбоз глубоких вен – состояние, при котором в венах образуются кровяные сгустки (тромбы), препятствующие нормальному току крови. В клинической практике тромбоз глубоких вен нижних конечностей встречается чаще, чем венозные тромбозы других локализаций. Клиническая симптоматика тромбоза глубоких вен включает распирающие боли, отечность, синюшность кожи, поверхностную гипертермию, болезненность при пальпации пораженной вены, набухание поверхностных вен. Окончательный диагноз устанавливается по данным УЗДГ вен нижних конечностей и дуплексного сканирования; для оценки микроциркуляции проводится реовазография. Лечение тромбоза глубоких вен проводится гепарином под контролем коагулограммы; при необходимости осуществляется хирургическое удаление образовавшегося тромба.
Тромбоз глубоких вен
Тромбоз глубоких вен – состояние, при котором в венах образуются кровяные сгустки (тромбы), препятствующие нормальному току крови. В клинической практике тромбоз глубоких вен нижних конечностей встречается чаще, чем венозные тромбозы других локализаций.
Тромбы могут образовываться не только в глубоких, но и в поверхностных венах, однако тромбоз поверхностных вен (поверхностный тромбофлебит) редко становится источником серьезных проблем. В отличие от тромбофлебита, тромбоз глубоких вен требует неотложной медицинской помощи в связи с риском развития опасных для жизни пациента осложнений.
Причины тромбоза глубоких вен
Для развития заболевания необходимо сочетание нескольких факторов:
- повреждение внутренней выстилки венозной стенки в результате воздействия механического, химического, аллергического или инфекционного агента;
- нарушение системы свертывания крови;
- замедление тока крови.
При некоторых обстоятельствах вязкость крови увеличивается. Если на стенках вены есть препятствия для нормального тока крови, увеличивается риск образования тромбов. Мелкий тромб, образующийся на венозной стенке, вызывает воспаление и дальнейшее повреждение стенки вены, которое становится причиной образования других тромбов.
Возникновению тромбоза глубоких вен способствуют застойные явления в венах нижних конечностей. Причиной застоя становится неподвижность или малоподвижность человека в течение долгого времени.
Пусковые факторы при тромбозе глубоких вен:
- травма, операция, чрезмерное физическое напряжение;
- инфекционное заболевание;
- длительная неподвижность при состояниях после хирургического вмешательства, неврологических и терапевтических заболеваниях;
- период после родов;
- прием пероральных гормональных контрацептивов;
- злокачественные опухоли (особенно – рак желудка, легких и поджелудочной железы);
- ДВС-синдром.
Риск развития заболевания увеличивается при продолжительном неподвижном положении с опущенными вниз ногами. Так, на Западе существуют термины «синдром экономического класса» и «телевизионный тромбофлебит». В первом случае речь идет о людях, у которых тромбоз глубоких вен развился после длительного перелета. Во втором – о пожилых пациентах, у которых заболевание появилось после долгого сидения перед телевизором. И в том и в другом случае пусковым фактором стало длительное пребывание в позе сидя с согнутыми ногами, при котором создаются препятствия нормальному венозному оттоку.
Возврат крови по венам в значительной степени обеспечивается сокращением мышц. После операций и при некоторых хронических заболеваниях пациент долгое время остается практически неподвижным. В результате в нижних конечностях развиваются застойные явления, приводящие к тромбозу глубоких вен.
При приеме оральных контрацептивов, болезнях крови, злокачественных опухолях тромбоз в значительной степени обусловлен гиперкоагуляцией (повышенной свертываемостью крови). В отдельных случаях нарушение кровотока в глубоких венах может свидетельствовать о болезни Бюргера (облитерирующем тромбангиите аллергического генеза).
Как правило, тромбоз глубоких вен развивается в области нижних конечностей. Однако, иногда наблюдаются и тромбозы глубоких вен в области рук, которые возникают при воздействии следующих пусковых факторов:
- катетеризация вен верхних конечностей. Катетер, находящийся в вене длительное время, вызывает раздражение венозной стенки и приводит к образованию тромба;
- имплантированный кардиофибриллятор или электрокардиостимулятор;
- злокачественное новообразование в области вены;
- чрезмерная нагрузка на верхние конечности у спортсменов (бейсболистов, пловцов, тяжелоатлетов). Заболевание развивается из-за сдавления глубоких вен верхних конечностей натренированными мышцами плечевого пояса.
Симптомы тромбоза глубоких вен
Симптомы зависят от локализации тромба. Примерно в половине случаев кровь через систему коммуникантных вен оттекает в подкожные вены, кровоток частично восстанавливается, и тромбоз глубоких вен протекает бессимптомно. У остальных больных наблюдается один или несколько следующих симптомов в различных сочетаниях:
- — распирающие боли в пораженной конечности;
- — боль при пальпации, усиливающаяся по ходу вены, в которой образовался тромб;
- — отеки;
- — местная гипертермия;
- — синюшность кожных покровов пораженной конечности;
- — набухшие поверхностные вены.
О перенесенном тромбозе могут свидетельствовать развитые венозные коллатерали в нижней части живота, в области тазобедренных суставов, бедра и голени.
Осложнения тромбоза глубоких вен
Исходом тромбоза глубоких вен может стать хроническая венозная недостаточность, в результате которой развиваются отеки нижних конечностей и нарушения трофики (липодерматосклероз, экзема, трофические язвы).
Самым опасным осложнением тромбоза глубоких вен является тромбоэмболия легочной артерии. Оторвавшиеся кусочки тромбов вместе с током крови двигаются в легкие, попадают в легочную артерию и вызывают ее эмболию (закупорку). Нарушение кровотока в легочной артерии приводит к развитию острой дыхательной и сердечной недостаточности и может стать причиной смерти пациента. В случае, когда кусочком тромба закупоривается мелкая ветвь легочной артерии, развивается инфаркт легкого.
Диагностика тромбоза глубоких вен
Современная флебология располагает хорошей технической базой для проведения оценки венозного кровотока и диагностики тромбоза глубоких вен. Как правило, диагноз устанавливает флеболог. Он проводит жгутовые пробы (эластическое бинтование ног по специальной методике), в том числе – маршевую пробу, при которой на ногу больного от пальцев до паха накладывается эластический бинт. Затем пациент некоторое время ходит. Распирающие боли и не спавшиеся после проведения пробы подкожные вены указывают на тромбоз.
Для оценки кровотока в глубоких венах применяется флебография, дуплексное сканирование и УЗДГ вен нижних конечностей и радионуклидное сканирование. Оценка состояния микроциркуляции проводится по данным реовазографии нижних конечностей.
Лечение тромбоза глубоких вен
В связи с риском развития опасных осложнений больные с тромбозом глубоких вен обязательно госпитализируются. Назначается строгий постельный режим. Пораженной конечности придают возвышенное положение. Чтобы предотвратить образование новых тромбов, пациенту назначают гепарин (обычно – в течение недели). Затем больного переводят на «мягкие» антикоагулянты (варфарин). Курс лечения варфарином продолжается 6 месяцев. Для контроля за состоянием системы свертываемости крови пациенту периодически проводится коагулограмма.
Тромболитические препараты эффективны только на ранних стадиях формирования тромба. В поздние сроки тромболитическая терапия опасна из-за возможной фрагментации тромба и развития тромбоэмболии легочной артерии. При выраженных нарушениях кровообращения в конечности показана тромбэктомия.
Профилактика тромбоза глубоких вен
Мероприятия, направленные на предупреждение тромбоза глубоких вен, заключаются в исключении факторов риска, использовании эластических чулок, ранней двигательной активности пациентов в послеоперационном периоде. В ряде случаев после операции назначают малые дозы ацетилсалициловой кислоты и гепарина, уменьшающих свертываемость крови.
Источники: http://health-kz.com/2015/07/21/tromboz-glubokih-ven-nizhnih-konechnostey-klinicheskiy-sluchay/, http://xn--80ahc0abogjs.com/terapiya-anesteziologiya-intensivnaya/tromboz-glubokih-ven-58999.html, http://www.krasotaimedicina.ru/diseases/zabolevanija_phlebology/thrombosis

