Тромбоз легочной артерии хирургия
Тромбоэмболия легочной артерии Учебное пособие
С о с т а в и т е л и:
Ассистент курса сердечно-сосудистой хирургии, кафедры госпитальной хирургии ИГМА, к.м.н. Бендерский Ю.Д.
Зав. рентгенодиагностическим отделением РДЦ, главный внештатный рентгенолог УР Бендерская Н.А.
Заведующий курсом сердечно-сосудистой хирургии, кафедры госпитальной хирургии ИГМА, к.м.н., доцент Киршин А.А.
Врач-кардиолог РКБ №3 Бендерская И.Д.
Врач-кардиолог РКБ №3 Помосов С.А.
Р е ц е н з е н т ы:
Зав. кафедрой госпитальной терапии ИГМА, д.м.н., профессор, главный внештатный кардиолог МЗ УР Максимов Н.И.
Зав. кафедрой госпитальной хирургии ИГМА, к.м.н., доцент Капустин Б.Б.
Учебное пособие предназначено для студентов. Введение
Одним из самых тяжелых и драматически протекающих сосудистых заболеваний является тромбоэмболия легочной артерии (ТЭЛА). ТЭЛА — составная часть синдрома тромбоза системы верхней и нижней полых вен.
В зарубежной практике ТЭЛА известна под названием «венозный тромбоэмболизм». В структуре летальности от сердечно-сосудистых заболеваний ТЭЛА занимает третье место после инфаркта миокарда (ИМ) и инсульта.
В развитых странах 0,1% населения погибает от ТЭЛА.
ТЭЛА обнаруживается при аутопсии у 12-15% пациентов, при этом от 27 до 68% этих смертей потенциально предотвратим.
Трудность диагностики ТЭЛА для практикующих врачей связана с тем, что, зачастую, клиническая картина ассоциируется с обострением основного заболевания (ишемическая болезнь сердца, хроническая сердечная недостаточность, хронические заболевания легких) или является одним из осложнений онкологических заболеваний, травм, обширных хирургических вмешательств. В то же время, такие специфические методы диагностики как ангиопульмонография, сцинтиграфия, перфузионно-вентиляционные исследования с изотопами, спиральная компьютерная и магнито-резонансная томография, осуществимы только в специализированных лечебных учреждениях.
Причиной ТЭЛА может стать венозный тромбоз любой локализации. Наиболее эмболоопасной является бассейн нижней полой вены, с которым связано около 90% всех ТЭЛА. Чаще всего первичный тромбоз находится в илиокавальных сегментах или подколенно-бедренных отделах вен нижних конечностей. Данная локализация венозного тромбоза осложняется ТЭЛА в более 50% случаев. Венозный тромбоз с локализацией в глубоких венах голени осложняется ТЭЛА от 1 до 5% случаев. Бассейн верхней полой вены дает 3,5% случаев ТЭЛА, которые возникают в результате постановки венозных катетеров, наличии тромбов в верхней полой вене и правом предсердии и их фрагментации на фоне мерцательной аритмии и дилатационной кардиомиопатии. Кроме того, эмболизация легочного сосудистого русла возможна при эндокардите трехстворчатого клапана и эндокардиальной электрокардиостимуляции, осложненной тромбозом правых отделов сердца.
Патогенез тромбоза вен определяется триадой Вирхова:
— повреждение эндотелия (флебит);
— замедление венозного кровотока;
Наибольшую опасность для развития ТЭЛА представляют «флотирующие тромбы», имеющие точку фиксации в дистальном отделе венозного русла, которые формируются в венах меньшего калибра и процесс тромбообразования прогрессивно распространяется в более крупные.
По данным различных авторов, эмболизация ствола и главных ветвей легочной артерии имеет место в 50%, долевых и сегментарных — в 22%, мелких ветвей — в 30% случаев. Одновременное поражение артерий обоих легких достигает 65% всех случаев ТЭЛА; в 20% поражается только правое; в 10% — только левое легкое.
При ТЭЛА возникает два механизма патологического процесса:
«механическая» обструкция сосудистого русла;
гуморальные нарушения, возникающие в результате выброса биологически активных веществ.
Можно выделить три рефлекторных механизма в генезе патофизиологических изменений:
падение системного артериального давления;
спазм не подвергнутых эмболизации легочных артерий и артериол;
рефлекторная одышка, которая наряду с уменьшением легочного кровотока способствует углублению гипоксии.
Обширная ТЭЛА увеличивает общее легочное сосудистое сопротивление (ОЛСС), препятствующее выбросу крови из правого желудочка, уменьшает наполнение левого желудочка, что приводит к снижению минутного объема (МО) крови и падению АД. ОЛЛС увеличивается и за счет вазоконстриции в результате высвобождения биологически активных веществ из агрегатов тромбоцитов в тромбе (тромбоксаны, гистамин, серотин). В результате окклюзии ветвей легочной артерии появляются неперфузируемые, но вентилируемые участки легочной ткани — так называемое «мертвое пространство». Выброс биологически активных веществ способствует локальной бронхообструкции в зоне поражения и развитию ателектаза легочной ткани, который появляется на вторые сутки после прекращения легочного кровотока.
Увеличение ОЛСС сопровождается развитием легочной гипертензии, открытием бронхолегочных шунтов и увеличением сброса крови справа налево. Возникает артериальная гипоксемия. Снижение доставки кислорода к легочной ткани через систему легочных, бронхиальных артерий и воздухоносных путей может явиться причиной развития инфаркта легкого.
Кардиолог — сайт о заболеваниях сердца и сосудов

Кардиолог онлайн

Кардиохирург онлайн
- Главная

- Сердечно-сосудистая хирургия

- Операции на сердце

- Хирургическое лечение тромбоэмболии легочной артерии (ТЭЛА)
Хирургическое лечение тромбоэмболии легочной артерии (ТЭЛА)
Тромбоэмболия легочной артерии (ТЭЛА) — третья по частоте после патологии сердца и злокачественных опухолей причина смерти. Приблизительно 75% патологоанатомически доказанных случаев не проявляются клинически.
Dalen выявил, что в Соединенных Штатах легочная эмболия развивается у 630 000 больных ежегодно. Из госпитализированных с ТЭЛА 12-21% пациентов погибают в стационаре и 24-39% умирают в течение 12 месяцев. Таким образом, 36-60% пациентов, которые переживают начальный эпизод, имеют различные клинические проявления постэмболического синдрома. Более 90% клинически диагностированных ТЭЛА связаны с тромбозом глубоких вен нижних конечностей, который у 2/3 больных протекает бессимптомно.
Прогноз для пациентов с легочной гипертензией неблагоприятен, особенно у тех из них, кто не имеет внутрисердечного шунта. Фактически, как только среднее легочное давление у пациентов ТЭЛА достигает 50 мм рт.ст. или выше, 3-летняя смертность приближается к 90%. Варианты хирургического лечения зависят и от первичного процесса болезни и от обратимости легочной гипертонии. Трансплантация легкого — единственный эффективный метод лечения пациентов с легочной гипертонией в терминальной стадии. Вместе с тем, связанные с ней побочные эффекты: более высокая смертность, длительное время ожидания и неудовлетворительный прогноз по сравнению с тромбэндартерэктомией делает трансплантацию проблематичной.
Тромбоз глубоких вен – основная причина ТЭЛА
Тромбоз глубоких вен прежде всего, затрагивает вены нижних конечностей и редко венозную систему в другом месте. Легочная эмболия также может быть следствием тромбоза правого предсердия, желудочка или печеночных вен. При микроскопическом исследовании тромбы выявляются в области клапанов вен. Тромбы состоят из фибрина, тромбоцитов большого эритроцитов.
В 1856 г. Rudolf Virchow предположил, что причины образования тромбов связаны с венозным застоем, повреждением стенки вены и гиперкоагуляцией. Эта триада этиологических факторов остается уместной сегодня и подтверждается растущим количеством современных исследований. Цитокины, интерлeйкин-I и фактор некроза опухоли, производимые макрофагами и другими клетками в различных патологических условиях стимулируют деятельность прокоагулянта эндлотелиальных клеток. Эти процессы могут объединиться с венозным застоем, микроскопическими повреждениями эндотелия, деятельностью прокоагулянтов крови, чтобы стимулировать формирование начального тромба в венозных карманах клапанов глубоких вен нижних конечностей. Некоторые пациенты с тромбозом глубоких вен имеют дефицит естественных антикоагулянтов: антитромбина — естественной плазменной протеазы, которая предотвращает образование тромбина; C-белка — мощного ингибитора V и VII факторов свертывания и S-белка, как кофактора для деятельности антикоагулянтов. У 6-7% населения гомо- и гетерозиготные мутации указанных факторов связаны с венозным тромбозом и легочной эмболией, в отличие от артериальных тромбозов при инфаркте миокарда.
В дополнение к трем классическим факторам риска, описанным выше, уменьшенная фибринолитическая активность крови может также внести свой вклад в развитие тромбоза. Снижение фибринолитической активности может быть следствием уменьшенного производства тканевого активатора профибринолизина (t-Пенсильвания) или увеличения концентрации ингибитора активатора профибринолизина-I. Кроме того, отмечено, что активность фибринолитиков меньше в венах нижних, чем в верхних конечностей, особенно у пожилых пациентов.
Наличие главных факторов риска увеличивает вероятность венозной томбоэмболии. У пациентов с клинически подозреваемым тромбозом глубоких вен — 50% с тремя факторами риска имеют доказанный диагноз тромбоза. С другой стороны, при отсутствии любых факторов риска тромбозы отмечены только в 11% больных.
Предыдущие томбоэмболии, пожилой возраст, хирургические операции на бедре или колене, множественная травма, и злокачественные опухоли – также серьезные факторы риска. У пациентов с венозной томбоэмболией в анамнезе риск развития нового эпизода в течение госпитализации — почти в восемь раз больше чем других больных. У 10% пациентов с первым эпизодом тромбоза глубоких вен или ТЭЛА и до 20% с текущим заболеванием развивается новый эпизод венозной тромбоэмболии в течение 6 месяцев. Больные в 70-80-летнем возрасте в 200 раз чаще страдают ТЭЛА, чем пациенты в возрасте 55 мм рт.ст., окклюзия более 50% артериального русла легких и уровень артериального насыщения О2 2
Результаты
Выживаемость после экстренной легочной тромбоэмболэктомии варьирует в пределах от 40% до 92%. В тех случаях, когда выполнение операции сопровождается проведением закрытого, а в последующем открытого массажа сердца без поддержки экстракорпоральной перфузии, летальность достигает 45-75%. В случаях выполнения операции без остановки сердца летальность колеблется от 8% до 36%. Основными причинами смерти являются ишемическое повреждение мозга, сердечная недостаточность и сепсис. Повторные тромбоэмболии достаточно редки. Около 80% выживших больных в отдаленном послеоперационном периоде имеют нормальное давление в легочной артерии и приемлемую толерантность к физической нагрузке. У 10% в отдаленном послеоперационном периоде сохраняется обструкция около 40-50% легочных сосудов, что значительно снижает функцию легких и толерантность к физической нагрузке.
Хроническая посттромбоэмболическая легочная гипертензия
Хроническая посттромбоэмболическая легочная гипертензия развивается у 0,1-0,5% выживших после тромбоэмболии легочной артерии пациентов.
Патоморфологические изменения
Патоморфологические изменения сводятся к тромбоэмболической окклюзии микрососудистого легочного русла. Легочная биопсия показывает наличие различной степени медиальной гипертрофии и тяжелой эксцентрической энтимальной фиброплазии. Такое эксцентричное развитие фиброзной ткани ассоциируется с плексогемической артериопатией. Появление таких тромботических повреждений приводит к распространению этого процесса от микрососудистого русла к сегментарным и лобулярным артериям чаще, чем развитие эмболии.
Патофизиология
Патофизиология развития легочной гипертензии включает увеличение постнагрузки для правого желудочка вследствие окклюзии легочных артерий и ее ветвей. В основе развития легочной гипертензии лежит снижение комплайнса (податливости) центральных легочных артерий. Комплайнс легочного русла в норме достаточно большой и может увеличиваться в 3-4 раза от состояния покоя. Комплайнс легочного русла кровообращения позволяет в 2-3 раза увеличить объем крови, прежде чем давление в легочной артерии увеличиться вдвое. Тромбоэмболические материалы препятствуют такой нормальной реакции легочного сосудистого русла.
Своевременное хирургическое лечение, освобождающее легочное русло кровообращения от обструктивных материалов позволяет открыть легочные сосуды и вызвать обратное развитие повреждения микроциркуляции.
Диагностика
Диагностика и лечение хронической посттромбоэмболической легочной гипертензии требует специфического подхода, как в плане оценки возможности хирургического вмешательства, так и возможности анестезии и послеоперационного ведения пациентов в отделении интенсивной терапии. При правильном подходе легочная тромбэндартерэктомия может быть осуществлена с приемлемым риском.
Нет никаких абсолютных клинических признаков, характерных для хронической ТЭЛА. Самый общий признак, связанный с легочной гипертензией – одышка. Обмороки или предобморочные состояний — другой общий признак легочной гипертензии. Неопределенные боли груди наблюдаются у 50% пациентов. Периферические отеки появляются при развитии недостаточности ПЖ. Физикальное обследование позволяет выявить яремный венозный пульс. У некоторых пациентов развивается цианоз. Аускультативно над легочной артерией II тон усилен, слышен систолический щелчок изгнания и диастолический шум недостаточности клапана ЛА, а также систолический шум недостаточности трехстворчатого клапана.
Тесты легочной функции показывают минимальные изменения в объеме легких и вентиляции. Пациенты имеют нормальную или немного ограниченную легочную механику. Жизненная емкость легких часто уменьшается и может быть единственным признаком нарушения функции легких. Давление в ЛА увеличено, сердечный выброс снижен. Анализ газов крови выявляют гипоксию (PaO2 53-80 мм рт.ст.), PaCO2 300 ед./сек./см -5 ) и функции газообмена во время отдыха или при физической нагрузке. У больных со II функциональным классом NYHA и меньшим легочным сопротивлением наиболее приемлемо медикаментозное лечение, особенно в случаях, если поражены сегментарные или субсегментарные артерии. Тромбэндартерэктомия из легочной артерии показана также пациентам, которые имеют нормальную или близкую к нормальной легочную гемодинамику в покое, однако при выполнении физической нагрузки давление в легочной артерии значительно возрастает.
Кроме указанных критериев необходимо оценивать:
• Уровень легочной гипертензии. Данные литературы показывают, что успех операции наиболее вероятен при уровне систолического давления в легочном стволе, не превышающем 90-95 мм рт.ст. С другой стороны, вряд ли оправдан риск тяжелого вмешательства у больных при давлении ниже 50 мм рт.ст., поскольку оно не может обусловить быстрого развития правожелудочковой недостаточности.
• Состояние дистального сосудистого русла легких. Основным критерием возможности выполнения тромбэндартерэктомии является локализация окклюзии легочного русла кровообращения. Успех возможен только при локализации тромбов в главной долевой или проксимальных отделах сегментарных артерий. В тех случаях, когда локализация окклюзирующих поражений легочного русла относится ко вторичным или более мелким артериях, то легочная тромбэндартерэктомия из основных главных сосудов не приводит к снижению давления в легочном русле в послеоперационном периоде. Однако в дооперационном периоде не просто решить вопрос о состоянии сегментарных легочных артерий, расположенных дистальнее зоны окклюзии. Частота форм гипертензии, подлежащих хирургическому лечению, оценивается L. Antebi (1962) в 25-30%. По мнению E. Hurwitt и соавт. (1958), она достигает 50%. Последняя цифра перекликается с результатами патологоанатомических исследований S. Orell (1962), показавшими, что в половине случаев постэмболическая окклюзия локализуется в главных легочных артериях.
• Длительность заболевания. Возможности хирургического вмешательства во многом зависят от длительности нахождения тромбов в легочных артериях. V.Dor и соавт. (1981) полагают, что лучшие результаты могут быть получены при выполнении операции в течение 6-8 недель от момента эмболической окклюзии. Существует и противоположная точка зрения, которая заключается в полном игнорировании этого фактора. Вместе с тем, восстановление проходимости главных легочных магистралей не может привести к выздоровлению, так как продолжительное существование высокой гипертензии малого круга кровообращения приводит к необратимым изменениям всей легочной сосудистой системы, паренхимы легких и миокарда. Такие больные являются кандидатами для трансплантации сердечно-легочного комплекса.
Чем меньше времени прошло с момента эмболии, тем операция технически легче выполнима. Из литературы ясно, что в первые недели и даже месяцы с момента тромбоэмболии процесс спонтанного восстановления проходимости легочного сосудистого русла может продолжаться. В более поздние сроки он идет уже за счет механической фрагментации, ретракции тромба и гуморального лизиса, а также благодаря процессу «органической фрагментации», вызванному прорастанием эндотелиоцитов, лизиса вросшими полимофноядерными лейкоцитами и фиброваскулярной организации.
По мнению V. Door и соавт. (1981), больные, у которых по данным ангиографиического и гемодинамического контроля отсутствует адекватное восстановление легочного кровотока в течение 3-4 недель с момента тромбоэмболии, должны быть оперированы. D. Sabiston и соавт. (1977), R.Symbas (1977), считают 3 месяца предельным сроком, после которого спонтанное или под влиянием медикаментозного лечения восстановление проходимости легочного сосудистого русла невозможно. Следует отметить, что быстрое прогрессирование симптомов сердечно-легочной недостаточности может сделать необходимым оперативное вмешательство еще до наступления этого контрольного срока.
Противопоказания к легочной тромбэндартерэктомии
Противопоказанием к выполнению легочной тромбэндартерэктомии является сопутствующее самостоятельное заболевание легких в виде обструктивного бронхита, старческий возраст, тяжелая правожелудочковая недостаточность.
Коронарная ангиография должна быть проведена пациентам с подозрением на ИБС. При необходимости АКШ выполняется одновременно с тромбэндартерэктомией. Имплантация кавафильтров в нижнюю полую вену, как правило, рекомендуется перед выполнением основной операции.
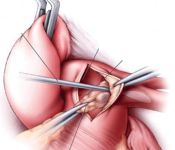
Легочная тромбэндартерэктомия. Техника операции
Оперативное вмешательство при хронических постэмболических поражениях представляет собой технически гораздо более сложную задачу, чем в острой стадии легочной эмболии. Плотное спаяние тромба с артериальной стенкой значительно удлиняет внутрисосудистый этап операции и в большинстве случаев требует обнажения не только легочного ствола, но также главных легочных артерий и их долевых ветвей. Вторым немаловажным фактором является наличие высокой гипертензии малого круга, какой не бывает в острой стадии заболевания. От этих обстоятельств зависят доступ, используемый во время операции, и условия, в которых она проводится.
Первую успешную легочную тромбэндартерэктомию осуществил Allison через стернотомию с использованием умеренной гипотермии. В 1978 г. Cabrol описал 16 больных после тромбэндартерэктомии. 14 больных из этой серии были оперированы через боковую торакотомию и двое через срединную стернотомию без искусственного кровообращения. Из 14 больных, оперированных в условиях искусственного кровообращения, 12 выжили. Эти операции производились с использованием глубокой гипотермии и временной остановки кровообращения, которая в последующем стала стандартной процедурой.
Под седацией мидазоламом проводится канюляция a.radialis, вен шеи и введение катетера Swan-Ganz в легочную артерию для постоянного контроля давления и сердечного выброса в режиме реального времени. Транспищеводная эхокардиография необходима для выявления открытого овального окна, которое может стать причиной парадоксальной эмболии из правых в левые отделы сердца. Операция выполняется под обезболиванием фентанилом, использованием миорелаксантов, для поддержания адекватной гемодинамики используются различные комбинации вазопрессорных катехоламинов.
Выполняется срединная стернотомия. Для защиты головного мозга может использоваться глубокая гипотермия, а также ретроградная цереброплегия во время полной остановки искусственного кровообращения, которая увеличивает время безопасной ишемии мозга с 15 до 30 минут.
Искусственное кровообращение проводиться в стандартном режиме – 2,4 л/мин/м 2 осуществляется посредством подключения по схеме: полые вены – аорта. Пациент охлаждается в течение 30 минут до достижения назофарингеальной температуры 15° С. Остановка сердца достигается анте- ретроградной кровяной кардиоплегией при 28° С. В случаях использования глубокой гипотермии по достижении температуры 15° С, останавливается искусственное кровообращение, начинается ретроградная перфузия головного мозга. Вскрывается продольно ствол легочной артерии с продлением разреза на левую и правую ветви легочной артерии.
Вскрытие ветвей легочной артерии
Проводится тщательное отделение эмболов, сросшихся с интимой. Процедура выполняется крайне деликатно для предотвращения повреждения адвентиции, которое, в последующем, может привести к массивному кровотечению. Удаление эмболов проводится, по возможности, до лобарных или сегментарных артерий последовательно из обоих ветвей легочной артерии. Выполняется тщательный дебридмент остатков старых тромбов с помощью отсоса, а также сдавлением легких для освобождения легочных сосудов от остатков детрита.
Извлеченный тромбоэмбол
В последующем проводится ушивание артериотомных отверстий одно- или двухрядным швом, согревание занимает от одного до полутора часов. Восстанавливается легочная вентиляция в это время идеальной является постоянная инфузия простагландина-I с дозировкой 0,5-1 ед./мин. После окончания согревания искусственное кровообращение отключается. Правожелудочковая недостаточность не является важной проблемой, если проведена адекватная защита миокарда. Использование добутамина или других катехоламинов проводится в зависимости от необходимости гемодинамической поддержки.
Послеоперационное ведение
Послеоперационное ведение не отличается от обычного ведения раннего послеоперационного периода у пациентов после использования искусственного кровообращения с постоянным контролем параметров гемодинамики, артериального и венозного давления, сатурации кислорода и т.д. Для поддержания гемодинамики возможна комбинация добутамина с фенилэпинефрином в комбинации с простагландинами и допамином. При необходимости используются небольшие дозы амринона или милринона.
При проведении искусственной вентиляции легких на начальном этапе раннего послеоперационного периода используется положительное давление на выдохе (5 мм рт. ст.) и инсуфляция 80-100% кислорода. Большинство больных экстубируется через 16-18 часов. Часть из пациентов в случаях гипоксемии и гидрокарбии требует вентиляционной поддержки в течение 1-2 недель с использованием положительного давления на выдохе.
Для профилактики инфекционных осложнений используется комбинация антибиотиков: цефалоспорина или ванкомицина в течение 3-х дней или во время всего периода искусственной вентиляции. Возобновление введения гепарина начинается после окончания поступления крови по дренажам, достижения частичного тромбопластинового времени 50-60 сек. В послеоперационном периоде рекомендовано применение комбинации непрямых антикоагулянтов (варфарин) с небольшими дозами аспирина (80 мг ежедневно) для поддержания МНО – 2,8-3,5.
Осложнения
Осложнения в послеоперационном периоде не отличаются от осложнений у пациентов, которым параллельно проводилась различная коррекция патологии сердца с использованием искусственного кровообращения. К ним относятся аритмии, ателектазы, раневые инфекции, пневмония или кровотечение.
Реперфузионные повреждения легких у большинства пациентов развиваются вследствие повышенной проницаемости легочного сосудистого русла для активированных нитрофилов. Они проявляется в первые 24 часа после выполнения операции и характеризуется артериальной гипоксемией, что рентгенологически проявляется инфильтратами в области сегментов легких, подвергшихся тромбэндартерэктомии. Тяжесть реперфузионных повреждений варьирует от средних форм, проявляющихся в послеоперационном периоде гипоксимией до реперфузионного отека легких, который может развиться в течение первых 2-3 дней после операции. Реперфузионный отек легких увеличивает физиологический шунт более чем на 30%, повышая необходимость в достижении высокого давления кислорода и снижения легочного комплайнса. Этот процесс также уменьшает количество легочного сурфактанта, приводит к ателектазам, с последующим развитием пневмонии. Реперфузионный отек легких очень похож на острый респираторный дистресс-синдром и должен лечиться агрессивным введением диуретиков, вентиляционной поддержкой с режимом положительного давления на выдохе, профилактикой инфекции в течение всего послеоперационного периода. Для коррекции возникших нарушений, как правило, назначается NO, который улучшает газообмен, однако не снижает необходимости вентиляционной поддержки и не увеличивает выживаемость. Наиболее оптимальным способом лечения является использование ЭКМО.
Злокачественная легочная артериальная гипертензия (спазм сосудов), в основном, должна контролироваться профилактическим назначением протагландина-I. Несмотря на то, что после окончания искусственного кровообращения у таких пациентов давление в легочной артерии составляет 50-60% системного и сравнимо с тем, что было до операции, в течение нескольких дней легочное давление значительно повышается, несмотря на использование нитроглицерина, гипокарбии, антихолиноэстеразных ингибиторов, добутамина, изопротеренола. Если не удается добиться снижения констрикции легочных артерий у этих больных развивается тяжелая правожелудочковая недостаточность. Механизм развития злокачественной легочной гипертензии не известен. K.M. Moser et al.(1985) считает, что этот феномен является «vascular steal» — «сосудистой кражей» и обусловлен гиперперфузией вследствие открытия легочного сосудистого русла после тромбэктомии. Несмотря на то, что в последнее время используется NO, способный снижать послеоперационное давление в легочной артерии с одновременным улучшением оксигенации, этого бывает недостаточно.
Остаточная легочная гипертензия после тромбэндартерэктомии, как правило, обусловлена невозможностью полного удаления эмболов из мелких артерий. Она сопровождается правожелудочковой недостаточностью. Основными направлениями в лечении являются снижение потребления кислорода, увеличение преднагрузки правого желудочка и агрессивная инотропная поддержка. Использование NO может улучшить газообмен у пациентов с тяжелыми реперфузионными повреждениями, но, как уже было сказано, не уменьшает необходимости в вентиляционной поддержке и не увеличивает выживаемость.
Неврологические осложнения, в основном, связаны с использованием глубокой гипотермии и обычно нивелируются в течение 2-3 дней после операции. Более тяжелые неврологические нарушения связаны с продленной остановкой кровообращения (больше 60 минут). [Fedullo P.F., Rubin L.J., Kerr K.M. et al., 2000].
Результаты. К 2003 году были описаны приблизительно около 4000 тромбэндартерэктомий из легочной артерии, из них 1500 выполнены в одном центре. Госпитальная (30-дневная летальность) составляет от 5,4% до 27%. До 1990 года она была на уровне 12,6-37,5%, но с накоплением опыта в последующие годы летальность значительно снизилась и с 1996 года составляла в различных центрах от 5 до 24%.
Одним из основных факторов риска является высокое легочное сопротивление больше 1100 ед./сек.cм -5 и послеоперационная длительность ИВЛ больше 5 дней, частично — продленное время искусственного кровообращения. По данным различных исследователей тяжелое поражение легочной артерии со средним давлением больше 50 мм рт.ст. легочного столба и средним легочным сопротивлением > 1100 ед./сек.см -5 сопровождается значительно большей летальностью 37% против 8%, если эти цифры значительно ниже.
Летальность, в основном, обусловлена высоким общим риском операции на открытом сердце. Основными причинами смерти после благополучно проведенной операции являются развитие злокачественной легочной гипертензии, правожелудочковая недостаточность, перфузионные повреждениями легких, резидуальная легочная гипертензия, кровотечение и другие осложнения, связанные с неврологическими нарушениями и правожелудочковой недостаточностью.
Улучшение давления наполнения правого желудочка и снижение давления в легочной артерии происходит в течение ближайших дней и достигает 50-60% от предоперационного уровня и приближается к нормальному. Легочное сопротивление, в среднем, снижается с 900 до 260 ед./сек.cм-5, а сердечный выброс увеличивается с 3,7 до 5,7 л/мин. Недостаточность трехстворчатого клапана уменьшается или исчезает.
В раннем послеоперационном периоде наблюдается снижение легочного сопротивления приблизительно у 65% больных. Параллельно с этим наблюдается улучшение газообмена и толерантности к физической нагрузке. Большинство больных, находящихся в III и IV функциональном классе NYHA перед операцией, после операции имеет I-II функциональный класс NYHA.
Рентгенограммы до- и после легочной тромбэндартерэктомии
Ангиограммы до- и после проведения легочной тромбэндартерэктомии
Отдаленные результаты
76% пациентов после операции находятся в I функциональном классе NYHA, остальные 24% — во II. В отдаленном послеоперационном периоде редко отмечается гипоксемия. Значительно снижается легочное сопротивление, увеличивается сердечный выброс.
Динамика легочного сопротивления ( ед./сек./cм -5 )
При адекватной антикоагулянтной терапии повторные эмболии легочной артерии достаточно редки. Иногда наблюдается правожелудочковая недостаточность, связанная в основном со вторичным изменением микроциркуляторного легочного кровеносного русла.
Продолжительная антикоагулянтая терапия абсолютно рекомендована пациентам после тромбэндартерэктомии. Для достижения терапевтического эффекта, предотвращающего тромбозы и повторные тромбоэмболии в легочную артерию, необходимо поддерживать адекватный уровень МНО (2-2,5). Пациенты, которым выполнение адекватной тромбэндартерэктомии не возможно, являются кандидатами для трансплантации сердца.
Становиться все более очевидным, что легочная гипертензия, вызванная хронической легочной эмболией, не подлежит медикаментозному лечению. Единственной альтернативой легочной тромбэмболэктомии является трансплантация легких. Преимущества тромбэмболэктомии включают более низкую госпитальную смертность и хорошие отдаленные результаты без риска, связанного с хронической иммунодепрессией и отторжением аллотрансплантата. Дальнейший прогресс хирургического лечения должен помочь большему количеству пациентов с этой, в конечном счете, фатальной болезнью.
Профессор, доктор медицинских наук Ю.П. Островский
Обзор тромбоэмболии легочной артерии: что это, симптомы и лечение
Из этой статьи вы узнаете: что такое тромбоэмболия легочной артерии (сокращенно ТЭЛА), какие причины приводят к ее развитию. Как проявляется и чем опасно это заболевание, как его лечить.
Автор статьи: Нивеличук Тарас, заведующий отделением анестезиологии и интенсивной терапии, стаж работы 8 лет. Высшее образование по специальности «Лечебное дело».
При тромбоэмболии легочной артерии происходит перекрытие тромбом артерии, несущей венозную кровь из сердца в легкие для обогащения кислородом.

Эмболия бывает разной (например, газовой – когда сосуд закупоривается пузырьком воздуха, бактериальной – закрытие просвета сосуда сгустком микроорганизмов). Обычно просвет легочной артерии блокируется тромбом, сформировавшимся в венах ног, рук, таза или в сердце. С током крови этот сгусток (эмбол) переносится в малый круг кровообращения и блокирует легочную артерию или одну из ее веток. Это нарушает кровоток в части легкого, из-за чего страдает обмен кислорода на углекислый газ.
Если тромбоэмболия легочной артерии тяжелая, то организм человека получает мало кислорода, что и вызывает клинические симптомы болезни. При критической нехватке кислорода появляется непосредственная опасность для жизни человека.
Проблемой ТЭЛА занимаются врачи различных специальностей, включая кардиологов, кардиохирургов, анестезиологов.
Причины ТЭЛА
Патология развивается вследствие тромбоза глубоких вен (ТГВ) в ногах. Тромб в этих венах может оторваться, перенестись в легочную артерию и блокировать ее. Причины образования тромбоза в сосудах описывает триада Вирхова, к которой принадлежат:
- Нарушение кровотока.
- Повреждение сосудистой стенки.
- Усиление свертываемости крови.

1. Нарушение кровотока
Основной причиной нарушений кровотока в венах ног является малоподвижность человека, которая приводит к застою крови в этих сосудах. Обычно это не является проблемой: как только человек начинает двигаться, кровоток усиливается, и тромбы не образуются. Однако длительная иммобилизация приводит к значительному ухудшению циркуляции крови и развитию тромбоза глубоких вен. Такие ситуации встречаются:
- после перенесенного инсульта;
- после операции или травмы;
- при других тяжелых заболеваниях, которые становятся причиной лежачего положения человека;
- при длительных перелетах в самолете, путешествиях в автомобиле или поезде.
2. Повреждение сосудистой стенки
При повреждении стенки сосуда его просвет может быть сужен или перекрыт, что приводит к формированию тромба. Кровеносные сосуды могут быть повреждены при травмах – при переломе костей, во время операций. Повреждать сосудистую стенку могут воспаление (васкулит) и определенные медикаменты (например, средства, применяемые для химиотерапии при раке).
3. Усиление свертываемости крови
Тромбоэмболия легочной артерии очень часто развивается у людей, имеющих заболевания, при которых кровь сворачивается легче, чем в норме. К таким болезням принадлежат:
- Злокачественные новообразования, применение химиотерапевтических препаратов, проведение лучевой терапии.
- Сердечная недостаточность.
- Тромбофилия – наследственное заболевание, при котором кровь человека имеет усиленную склонность к образованию тромбов.
- Антифосфолипидный синдром – заболевание иммунной системы, которое вызывает увеличение густоты крови, из-за чего легче образуются тромбы.
Другие факторы, увеличивающие риск ТЭЛА
Существуют другие факторы, повышающие риск развития ТЭЛА. К ним принадлежат:
- Возраст старше 60 лет.
- Ранее перенесенный тромбоз глубоких вен.
- Наличие родственника, который в прошлом имел тромбоз глубоких вен.
- Избыточный вес или ожирение.
- Беременность: риск ТЭЛА увеличен до 6 недель после родов.
- Курение.
- Прием противозачаточных таблеток или проведение гормональной терапии.
Характерные симптомы
У тромбоэмболии легочной артерии симптомы следующие:
- Боль в груди, имеющая обычно острый характер и ухудшающаяся при глубоком дыхании.
- Кашель с кровянистой мокротой (кровохарканье).
- Одышка – человек может иметь затрудненное дыхание даже в состоянии покоя, а при физической нагрузке одышка ухудшается.
- Увеличение температуры тела.

В зависимости от величины перекрытой артерии и количества легочной ткани, в которой нарушен кровоток, жизненные показатели (артериальное давление, частота сердечных сокращений, насыщение крови кислородом и частота дыхания) могут быть нормальными или патологическими.
Классические признаки ТЭЛА включают:
- тахикардию – повышенная частота сердечных сокращений;
- тахипноэ – увеличенная частота дыхания;
- снижение насыщения крови кислородом, которое приводит к цианозу (изменению цвета кожи и слизистых оболочек на синий);
- гипотензия – падение артериального давления.
Дальнейшее развитие болезни:
- Организм пытается компенсировать нехватку кислорода путем повышения частоты сердечных сокращений и дыхания.
- Это может стать причиной слабости и головокружения, так как органам, особенно головному мозгу, недостаточно кислорода для нормального функционирования.
- Тромб больших размеров может полностью перекрыть кровоток в легочной артерии, что приводит к немедленной смерти человека.
Так как большинство случаев легочной эмболии вызвано тромбозом сосудов в ногах, врачи обязательно обращают особое внимание на симптомы этого заболевания, к которым принадлежат:
- Боль, отек и повышенная чувствительность в одной из нижних конечностей.
- Горячая кожа и покраснение над местом тромбоза.
Диагностика
Диагноз тромбоэмболии устанавливают на основании жалоб пациента, врачебного осмотра и с помощью дополнительных методов обследования. Иногда легочную эмболию очень трудно диагностировать, так как ее клиническая картина может быть очень разнообразной и подобной другим заболеваниям.
Для уточнения диагноза проводят:
- Электрокардиографию.
- Анализ крови на Д-димер – вещество, уровень которого увеличивается при наличии тромбоза в организме. При нормальном уровне Д-димера тромбоэмболия легочной артерии отсутствует.
- Определение уровня кислорода и углекислого газа в крови.
- Рентгенографию органов грудной полости.
- Вентиляционно-перфузионное сканирование – используется для изучения газообмена и кровотока в легких.
- Ангиографию легочной артерии – рентгенологическое обследование сосудов легких с помощью контрастирования. С помощью этого обследования можно выявить эмболы в легочной артерии.
- Ангиографию легочной артерии с помощью компьютерной или магнитно-резонансной томографии.
- Ультразвуковое обследование вен нижних конечностей.
- Эхокардиоскопию – ультразвуковое исследование сердца.
Методы лечения
Выбор тактики лечения легочной эмболии осуществляет врач на основании наличия или отсутствия непосредственной опасности для жизни пациента.
При ТЭЛА лечение главным образом осуществляется с помощью антикоагулянтов – лекарственных средств, которые ослабляют сворачиваемость крови. Они предотвращают увеличение размеров тромба, благодаря чему организм медленно их рассасывает. Антикоагулянты также уменьшают риск дальнейшего образования тромбов.
В тяжелых случаях необходимо лечение, направленное на устранение тромба. Это можно сделать с помощью тромболитиков (препараты, расщепляющие тромбы) или хирургического вмешательства.
Антикоагулянты
Антикоагулянты часто называют кроверазжижающими препаратами, но они на самом деле не обладают способностью разжижать кровь. Они оказывают влияние на факторы свертываемости крови, благодаря чему предотвращают легкое образование тромбов.
Главными антикоагулянтами, которые применяются при легочной эмболии, являются гепарин и варфарин.

Гепарин вводится в организм с помощью внутривенных или подкожных инъекций. Этот препарат применяется в основном на начальных этапах лечения ТЭЛА, так как его действие развивается очень быстро. Гепарин может вызвать следующие побочные эффекты:
- повышение температуры тела;
- головные боли;
- кровотечения.
Большинству пациентов с легочной тромбоэмболией необходимо лечение гепарином в течение как минимум 5 дней. Затем им назначают пероральный прием таблеток варфарина. Действие этого препарата развивается медленнее, его назначают для длительного приема после прекращения введения гепарина. Этот препарат рекомендуют принимать не менее 3 месяцев, хотя некоторым пациентам нужно более длительное лечение.
Так как варфарин действует на сворачиваемость крови, пациентам нужно тщательно контролировать его действие с помощью регулярного определения коагулограммы (анализ крови на сворачиваемость). Эти анализы проводят амбулаторно.
В начале курса лечения варфарином может понадобиться 2–3 раза в неделю сдавать анализы, это помогает определить подходящую дозу препарата. После этого частота определения коагулограммы – примерно 1 раз в месяц.
На действие варфарина влияют различные факторы, включая питание, прием других лекарственных средств, функционирование печени.
Источники: http://studfiles.net/preview/4333063/, http://cardiolog.org/cardiohirurgia/operacii-na-serdce/xir-tela.html, http://okardio.com/bolezni-sosudov/tehla-324.html