Тромбоз аневризмы левого желудочка
Тромб верхушки левого желудочка
Анализ причин, симптоматика и лечение различных видов артериального тромбоза
Кровь обогащает ткани и клетки необходимым всем кислородом, питательными веществами, забирает вредные вещества и продукты жизнедеятельности клетки. Через кровь осуществляется регуляторная функция организма насыщения гормонами. Из-за постоянной работы без передышки сосуды и сердце подвержены большему риску выйти из строя, чем остальные органы. Основной проблемой для человека является острый артериальный тромбоз. Это заболевание, в ходе которого тромб частично или полностью перекрывает просвет сосуда. Последствия процесса – ишемизация ткани и дальнейший некроз части тела или органа, которые питал сосуд, после места закупорки.

Факторы риска и почему возникает патология
Артериальные тромбозы и эмболии (закупорка сосуда меньшего диаметра оторвавшимся тромбом) не возникают без воспаления сосудистой стенки. Основной причиной этого является облитерирующий атеросклероз. При этом на эрозированном участке прикрепляются атеросклеротические бляшки – основная причина тромбоза. В раннем периоде течение болезни будет проходить без симптомов, до того момента, пока бляшки не перекроют просвет сосуда на 70%. Тогда появятся первые симптомы. Основой бляшки является холестерин и липопротеиды очень низкой плотности. Когда в крови их количество превышает норму, можно говорить о риске и причине развития заболевания.
Еще одной причиной тромбоза может стать ухудшение реологических свойств крови. Повышенная свертываемость крови может привести к данной проблеме. Также тромбоз артерий может быть обусловлен такими причинами, как образовавшийся тромб в полости сердца, который закупорил сосуд меньшего диаметра. Он может остановиться как в артериальных, так и в венозных сосудах и стать причиной закупорки. Это может случиться при нарушении работы сердца – фибрилляции предсердий или желудочков, недостаточности клапанов, пароксизмальной тахикардии, эндокардите, аневризме левого желудочка.
Как проявляется недуг
Симптомы болезни зависят от места образования тромба или эмболии. Рассмотрим наиболее распространенные. Тромбоз внутренней сонной артерии может развиваться по нескольким причинам и схемам. Клиническими симптомами тромбоза магистральных сосудов могут быть головокружение, потеря сознания при попытке перевести больного из горизонтального положения в вертикальное, нарушение речи, сильная головная боль приступами, расстройства психики, галлюцинации.
При тромбозе базилярной артерии место закупорки может быть любой локализации, но наиболее частой является проксимальная часть с переходом на дистальный отдел позвоночной артерии. При данной патологии базилярной артерии наблюдаются симптомы ишемического инсульта с поражением центров двигательной активности, речи, нарушением походки (мозжечковая атаксия), тошнотой, рвотой, нарушением чувствительности. Если поздно начать лечение, эти осложнения могут стать причиной того, что наступит летальный исход при развитии стволового синдрома.
Нарушение проходимости позвоночной артерии встречается достаточно часто. Обычное место тромбоза позвоночной артерии – отхождение последней от подключичной артерии. Частый исход данной патологии – такие симптомы, как транзиторные нарушения деятельности головного мозга:
- Головокружение.
- Диплопия (двоение в глазах).
- Нарушение координации и статики.
- Слабость и преходящее нарушение чувствительности конечностей.
Это возникает по причине недостаточного кровоснабжения задних отделов мозга. Бывают стойкие нарушения чувствительности, симптомы пареза конечностей. Оптимальная диагностика – МРТ с контрастированием.
Основной причиной тромбоза центральной артерии сетчатки глаза является предшествующий спазм сосуда. Спазм центральной артерии может произойти при заболеваниях вегетативной нервной системы, по причине эндокринных нарушений, на фоне гипертонической болезни. Основными симптомами выступает потеря зрения – полная или частичная – чаще в утренние часы. За определенный период по причине ишемизации ткани происходит атрофия зрительного нерва. Может быть потеря зрения, а при закупорке одной из ветвей центральной артерии сетчатки – потеря цветового зрения. Диагностика при этом может заключаться в осмотре глазного дна офтальмологом.
Больные часто отмечают предвестники симптомов тромбоза. За несколько дней до острого тромбоза мелькают мушки перед глазами, по этой причине снижается четкость зрения, можно увидеть искры, кратковременная потеря зрения с дальнейшим его восстановлением. Окклюзия подключичной артерии становится причиной ишемии и выключения функции верхних конечностей и головного мозга. Этот сосуд берет начало от одного из магистральных сосудов – аорты, он меньшего диаметра, поэтому при коронарной недостаточности и нарушении ритма сердца образовавшийся тромб может закупорить устье подключичной артерии.
Симптомами данной патологии являются:
- Мышечная слабость и болезненность в руке (особенно в плечевой зоне) при любой нагрузке и в покое.
- Нарушение речи, зрения.
- Выпадение рефлекса глотания.
При тромбозе плечевой артерии наблюдаются те же изменения и симптомы, что и при окклюзии подключичной артерии, только без нарушения мозгового кровообращения. При тромбозе лучевой артерии функция нарушается не всей руки, а только той ткани, которую кровоснабжает сосуд. После тромбоза больные чувствуют такие симптомы: онемение, мышечную слабость половины руки с лучевой стороны от локтя, большого и указательного пальцев. Теряется возможность выполнения движений первым и вторым пальцем.
Тромбоз почечной артерии является нередким заболеванием. Обычно бляшки образуются в устье почечной артерии, где сосуд делится и становится меньшего диаметра. Чаще всего острый тромбоз происходит по причине спазма сосудов или болезни Такаясу (панартериит – воспаление всей сосудистой стенки). Крайней степенью будет нефрэктомия.
Основной симптом тромбоза – сильная боль в поясничной области и повышенное давление за счет систолического. Это уже должно натолкнуть врача на мысль о тромбозе почечного сосуда. К боли в пояснице добавляются такие симптомы:
- Рвота.
- Олигурия (уменьшение мочеиспускания).
- Задержка стула.
Тромбоз селезеночной артерии может произойти при заболеваниях сердца (эндокардитах, после инфаркта миокарда при коронарной недостаточности), травме селезенки – это основные причины. Симптомы в остром периоде проявляются болью в правом подреберье, которая иррадиирует под лопатку и в поясницу, парезом кишечника, тошнотой, рвотой.
Аналогичными симптомами проявляется окклюзия брыжеечной артерии, мезентериальных сосудов. Так как они питают кишечник, наблюдаются такие симптомы, как парез, отсутствие стула, перистальтики, болезненность живота, слабость, повышение температуры.
Одним из грозных осложнений при лечении гемодиализом (окклюзия артериовенозной фистулы) или установки протеза также является тромбоз.
Как бороться с недугом
В лечении данной патологии важна скорость обращения к врачу. Чем быстрее будет проведена диагностика и неотложная помощь, тем меньше клеток погибнет, и больше вероятность полного восстановления функции органа и чувствительности и двигательной активности конечностей.
Ни в коем случае нельзя заниматься самостоятельным лечением. В этой ситуации любые ваши действия будут направлены против вас. В зависимости от стадии и времени, которое прошло после момента окклюзии, выбирают консервативное или оперативное лечение. Консервативное лечение используется в раннем периоде. Для этого используют антикоагулянты прямого действия, в дальнейшем их заменяют на антикоагулянты непрямого действия.
В комплекс лечения включают также антиагреганты, которые помогут восстановить и улучшить реологические свойства крови. Спазмолитики снимут компенсаторный мышечный спазм для повышения текучести крови, увеличения просвета и создания минимального прохода для крови через тромб. Симптоматическое лечение включает в себя прием обезболивающих наркотических и ненаркотических, так как часто тромбоз сопровождается болезненностью. В качестве консервативного лечения показана физиотерапия.
Хирургическое лечение применяется в позднем периоде и является лучшим методом утилизации тромба. На сегодня есть 2 метода операционного лечения: прямая и непрямая тромбэктомия. В одном случае разрез делают непосредственно над пораженной артерией (на бедренной артерии, сосудах голени, артериовенозной фистулы) и тромбом. В другом случае ищут обходные и наиболее приемлемые пути (при окклюзии брыжеечной артерии, мезентериальных сосудов). Удалить тромбоз можно:
- Воздушным отсосом.
- Петлей.
- Методом выдавливания.
- Зондом Фогарти – используется чаще других.
Хирургическое лечение впоследствии дополняется консервативным в послеоперационном периоде, о котором написано выше. Еще одним методом лечения в хирургии является шунтирование (при коронарной недостаточности, бедренной окклюзии, тромбозе артериовенозной фистулы). Данный метод позволяет с помощью УЗИ дойти до места окклюзии и расправить стент, что закроет пораженную стенку и увеличит просвет сосуда, разрушив тромб.
При неблагоприятном исходе, несвоевременном лечении возможна ампутация органа или конечности, нефрэктомия, удаление селезенки, ампутация выше голени и др.
Острый тромбоз артерий – грозное заболевание, от которого не застрахован никто. После первых симптомов, когда возник тромбоз, нужно немедленно вызывать скорую помощь, ведь даже минуты могут изменить исход лечения – спасти жизнь или оставить орган.
Аневризма желудочка сердца
Аневризма желудочка сердца — это локальное ограниченное выпячивание истонченного и не сокращающегося участка стенки желудочка, состоящего из омертвевшей или рубцовой ткани. На месте повреждения стенка сердечной мышцы истончается и теряет способность сокращаться. Под действием давления крови истонченный участок сердечной мышцы постепенно выпячивается наружу – образуется аневризма. В большинстве случаев она возникает в стенке левого желудочка, часто — на передне-боковой стенке и верхушке. Также часто полость приобретенной аневризмы выстилает пристеночный тромб (сгусток крови), что может служить источником тромбоза (прижизненное образование сгустков крови в просвете сосудов) различных сосудов организма. Аневризмы сердца в области правого желудочка и предсердия встречаются крайне редко.
Симптомы аневризмы желудочка сердца
- Признаки сердечной недостаточности: одышка, приступы удушья, отеки.
- Нарушения сердечного ритма: обмороки, ощущение перебоев в работе сердца (неровная работа, « перевороты», приступы учащенного сердцебиения).
- Тупые боли в области сердца.
- Часто сохраняющиеся после инфаркта приступы стенокардии: боли или чувство дискомфорта за грудиной при физической и эмоциональной нагрузке и в состоянии покоя.
Различают врожденные и приобретенные аневризмы сердца.
- Приобретенные аневризмы сердца делят на:
- посттравматические — возникают вследствие травмы;
- инфекционные — возникают на фоне инфекционных заболеваний;
- постинфарктные — возникают после перенесенного инфаркта миокарда (тяжелое заболевание, характеризующееся гибелью части сократительных клеток мышцы сердца с последующим замещением погибших (некротизированных) клеток грубой соединительной тканью (то есть формирование постинфарктного рубца)).
- По структуре и строению выделяют следующие виды постинфарктных аневризм:
- истинные аневризмы(аневризма желудочка сердца) —локальное ограниченное выпячивание истонченного и не сокращающегося участка стенки левого желудочка, состоящего из омертвевшей или рубцовой ткани;
- ложные аневризмы —формирующиеся при разрыве стенки миокарда (мышечная оболочка сердца) и ограниченные перикардом (околосердечная сумка», наружная оболочка сердца). Для них характерна высокая вероятность разрыва, поэтому при большом дефекте она подлежит хирургическому лечению;
- функциональные аневризмы —зоны жизнеспособного, гибернирующего (« оглушенного» или « спящего») миокарда (мышечной оболочки сердца), утратившего сократительную способность и выпячивающегося при систоле (сокращении) желудочков. При восстановлении в этой зоне коронарного кровотока (поступление крови в сосуды, питающие сердце в этой области) аневризма исчезает.
- По форме аневризмы сердца могут быть:
- диффузными(плоскими);
- мешковидными (характеризуются наличием « шейки», которая, расширяясь, образует мешковидную полость);
- расслаивающими(образуются вследствие разрыва эндокарда (внутренней оболочки сердца), в толще миокарда под эпикардом (наружная оболочка сердца) формируется мешок).
- Инфаркт миокарда (тяжелое заболевание, характеризующееся гибелью части сократительных клеток мышцы сердца с последующим замещением погибших (некротизированных) клеток грубой соединительной тканью (то есть формирование постинфарктного рубца)). Основными факторами, способствующими образованию аневризмы, являются:
- обширное трансмуральное поражение (поражение всех слоев стенки сердца) левого желудочка;
- сопутствующая артериальная гипертензия (стойкое повышение артериального давления);
- чрезмерная физическая активность больного в течение 8 недель с момента возникновения инфаркта миокарда;
- нарушение процесса « заживления» миокарда (мышечной оболочки сердца) после инфаркта.
- Формирование дивертикул (мешковидные выпячивания стенок) желудочков сердца, возникающих при врожденных аневризмах.
- Инфекционные заболевания — причина возникновения инфекционных аневризм сердца. Среди них выделяют:
- сифилис (заболевание, передающееся половым путем и поражающее кожу и системы организма, вызываемое инфекционным возбудителем — бледной трепонемой);
- ревматизм (заболевание соединительной ткани (суставы, внутренняя оболочка сердца и т.п.), возникающее чаще всего после перенесенной ангины (воспаление миндалин));
- бактериальный эндокардит (воспаление внутренней оболочки сердца бактериальной природы).
Врач кардиолог поможет при лечении заболевания
Диагностика
- Анализ анамнеза заболевания и жалоб (когда появились одышка, приступы удушья, перебои в работе сердца, приступы учащенного сердцебиения, отеки нижних конечностей, снижение физической активности, с чем пациент связывает возникновение этих симптомов; перенес ли пациент инфаркт миокарда (тяжелое заболевание, характеризующееся гибелью части сократительных клеток мышцы сердца с последующим замещением погибших (некротизированных) клеток грубой соединительной тканью (то есть формирование постинфарктного рубца) или травму сердца).
- Анализ семейного анамнеза (есть ли у кого-то из близких родственников заболевания сердца, какие; были ли в семье случаи внезапной смерти).
- Анализ крови и мочи (для выявления сопутствующей патологии, которая может повлиять на течение заболевания).
- ЭКГ (электрокардиограмма) – определяется наличие специфических изменений на ЭКГ, характерных для аневризмы.
- ЭхоКГ (эхо-кардиография или ультразвуковое исследование сердца) — выявляется аневризма, ее размеры, определяется наличие тромбоза полости сердца (прижизненное образование сгустков крови в просвете сосудов или в полостях сердца), происходит дифференцировка (определение вида) аневризм.
- Рентгенография органов грудной клетки – выявляется увеличение размеров сердца, отек легких.
- Вентрикулография сердца радиоизотопная – используются специальные радиоактивные частицы, вводимые внутривенно, которые накапливаются в ткани сердца и позволяют определить расположения и размеры аневризмы, сократительную функцию миокарда (мышцы сердца) в покое и при нагрузке при помощи специальной аппаратуры.
- МРТ (магнитно-резонансная томография) сердца с контрастированием: проводят при противопоказаниях к инвазивной процедуре (с непосредственным проникновением с помощью катетера в сосуды и полости сердца). Пациенту внутривенно вводят контрастное вещество (препарат, обеспечивающий контрастное усиление полости органа при исследовании) и проводят процедуру магнитно-резонансной томографии (метод исследования внутренних органов и тканей, основанный на создании изображения с помощью магнитного поля и электромагнитных волн, позволяющий делать детальные снимки органов в различных плоскостях). Позволяет определить наличие и степень сужения собственных артерий сердца и точно увидеть размеры, расположение и вид аневризмы, построить трехмерную структуру сердца. Исследование играет очень важную роль, так как благодаря ей врач определяет тактику хирургического лечения
- Коронарная ангиография с рентгенконтрастной вентрикулографией — инвазивная методика, выполняют ее всем пациентам, которым необходимо оперативное лечение, и пациентам, у которых ранее выявили ишемию (недостаточное содержание крови в сердце, вызванное сужением или полным закрытием просвета артерии, питающей сердце). Позволяет наиболее точно определить наличие и степень сужения собственных артерий сердца и точно увидеть размеры, расположение и вид аневризмы, определить, как сокращается сердце.
- Электрофизиологическое исследование (исследование электрической системы сердца — специальная система, производящая и проводящая электрический импульс в сердце). Показано пациентам с желудочковыми аритмиями (нарушение нормального ритма работы сердца, происходящее из желудочков сердца, значительно повышающее вероятность внезапной смерти при наличии клинических проявлений (перебои в работе сердца, обмороки). Цель обследования — выявление характера и степени нарушений ритма сердца и определение дальнейшей тактики лечения.
Лечение аневризмы желудочка сердца
- Лекарственная терапия. Проводят лечение:
- стенокардии (заболевание, характеризующееся болезненным ощущением или чувством дискомфорта за грудиной). Назначаются антитромбоцитарные (предотвращают образование сгустков крови в сосудах), антиангинальные препараты (предупреждают, снимают приступы стенокардии, увеличивают продолжительность жизни), статины (препараты, уменьшающие уровень « плохого» холестерина, который способствует образованию холестериновых бляшек), ингибиторы ангиотензинпревращающего фермента (препараты, влияющие на систему, регулирующую кровяное давление и объем крови в организме);
- нарушений ритма сердца (любой ритм сердца, отличающийся от нормального). Назначают антиаритмические препараты (препараты для лечения нарушений ритма) разных классов. При тромбозе (прижизненное образование сгустков крови в просвете сосудов или в полости сердца) назначают антикоагулянты (препараты, уменьшающие свертываемость крови).
- Хирургическое лечение показано при большом размере аневризмы (более 22% площади стенки левого желудочка) при наличии следующих клинических показаний:
- выраженная сердечная недостаточность (одышка, отеки);
- угрожающие жизни больного желудочковые нарушения ритма сердца (аритмии (нарушение нормального ритма работы сердца), происходящие из желудочков сердца, значительно повышающие вероятность внезапной смерти);
- наличие ложной аневризмы (аневризма, формирующаяся при разрыве стенки миокарда (мышечная оболочка сердца) и ограниченная перикардом (околосердечная сумка», наружная оболочка сердца)). Для нее характерна высокая вероятность разрыва;
- врожденная аневризма (врожденные мешковидные выпячивания стенки сердца);
- асимптомные (протекающие без симптомов) аневризмы при прогрессивном увеличении их размеров;
- тяжелая митральная регургитация (возврат части крови обратно в предсердие из желудочка через « пропускающий» митральный клапан).
Осложнения и последствия
- Развитие сердечной недостаточности (появление отеков, одышки, приступов удушья).
- Возникновение аритмии сердца (любой ритм сердца, отличный от нормального, — ритма здорового человека).
- Возникновение тромбоза (прижизненное образование сгустков крови в просвете сосудов или в полости сердца).
Среди факторов, оказывающих негативное влияние на прогноз заболевания, выделяют:
- возраст (чем старше пациент, тем хуже прогноз);
- класс сердечной недостаточности (то есть степень выраженности сердечной недостаточности);
- наличие эпизодов приступов стенокардии (боли или чувство дискомфорта за грудиной при физической и эмоциональной нагрузке или в состоянии покоя);
- митральная регургитация (возврат части крови обратно в предсердие из желудочка через « пропускающий» митральный клапан (клапан между левым предсердием и левым желудочком сердца));
- желудочковые аритмии (нарушение нормального ритма работы сердца, происходящее из желудочков сердца, значительно повышающее вероятность внезапной смерти);
- объем (размер) аневризмы (чем он больше, тем хуже прогноз).
Профилактика аневризмы желудочка сердца
- Профилактика инфаркта миокарда (тяжелое заболевание, характеризующееся гибелью части сократительных клеток мышцы сердца с последующим замещением погибших (некротизированных) клеток грубой соединительной тканью (то есть формирование постинфарктного рубца)), атеросклероза (заболевание, возникающее вследствие нарушения жирового обмена и сопровождающееся отложением холестерина и его фракций в стенке сосудов).
- Диета: суточное потребление жира не должно превышать 30% (в среднем около 60 граммов) от калорийности суточного рациона питания. Необходимо сократить прием жиров животного происхождения. Особое внимание стоит уделить растительным маслам и рыбе жирных сортов.
- Регулярная физическая активность (не менее 30 минут в день).
- Отказ от курения.
- Контроль массы тела.
- Исключение интенсивных психоэмоциональных нагрузок (стрессы, конфликтные ситуации дома и на работе).
- Строгое соблюдение двигательного режима для больных с инфарктом миокарда (тяжелое заболевание, характеризующееся гибелью части сократительных клеток мышцы сердца с последующим замещением погибших (некротизированных) клеток грубой соединительной тканью (то есть формирование постинфарктного рубца)). Сначала больному следует придерживаться строгого постельного режима, затем постепенно увеличивать двигательную активность, избегая при этом длительных интенсивных нагрузок (в течение 2 месяцев).
- Контроль артериального давления (не более 139/89 мм рт.ст.).
- Своевременное обращение за медицинской помощью при появлении длительного (более 5 минут) приступа загрудинных болей.
Дополнительно
Ройтберг Г.Е., Струтынский А.В. Внутренние болезни. Сердечно-сосудистая система. М.: « Издательство БИНОМ» 2003.
Бунин Ю.А. Лечение неотложных состояний в кардиологии. Часть 2. Практическая кардиология- М.: Прогресс-Традиция, 2007.
Что делать при аневризме желудочка сердца?
- Выбрать подходящего врача кардиолог
- Сдать анализы
- Получить от врача схему лечения
- Выполнить все рекомендации
Кардиолог — сайт о заболеваниях сердца и сосудов

Кардиолог онлайн

Кардиохирург онлайн
- Главная

- Сердечно-сосудистая хирургия

- Операции на сердце

- Аневризма левого желудочка
Аневризма левого желудочка
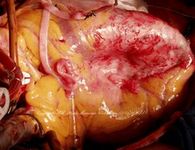
Аневризма левого желудочка — хорошо очерченная область тонкого рубца, лишенного мышечного слоя, развивающегося после инфаркта миокарда с систолической акинезией или дискинезией, уменьшающая фракцию изгнания левого желудочка.
Во время операции, левожелудочковая аневризма может также быть определена как область, которая спадается после декомпрессии левого желудочка.
Истинные левые желудочковые аневризмы определяются как выпячивание всей толщины стенки левого желудочка, в то время как ложная аневризма левого желудочка, фактически является разрывом его стенки, сдерживающейся окружающим перикардом. Схематическое изображение формирования аневризмы левого желудочка и различие между нормальной формой левого желудочка и аневризмой представлено на рисунках:
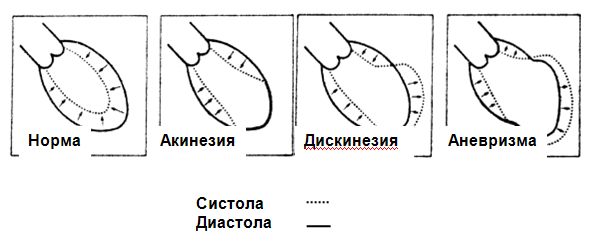
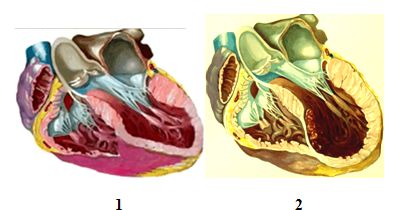
Желудочковые аневризмы описывались на аутопсии, но до 1881 г. не воспринимались следствием коронарной болезни. Ангиографический диагноз аневризмы левого желудочка был впервые установлен в 1951 г. Современная эра хирургического лечения началась в 1958 г., когда D.Cooley успешно выполнил линейную реконструкцию аневризмы, используя сердечно-легочный обход.
В зависимости от используемых методов диагностики частота аневризм левого желудочка у пациентов, перенесших инфаркт миокарда, составляет 10-35%. Из пациентов, подвергающихся сердечному зондированию в исследовании Coronary Artery Surgery Study (CASS) – 7,6% имели ангиографическое свидетельство аневризм левого желудочка. В последние годы вследствие использования тромболитической терапии и первичной ангиопластики частота этого осложнения после инфаркта миокарда снижается.
Более 95% истинных аневризм являются следствием инфаркта миокарда. Истинные левые желудочковые аневризмы также могут быть следствием травмы, болезни Чага, или саркоидоза и в очень небольшом проценте — в виде врожденных дивертикулов левого желудочка. Ложные аневризмы левого желудочка обычно являются следствием состоявшегося разрыва желудочка спустя 5-10 дней после инфаркта миокарда и часто развиваются в результате тромбоза огибающей ветви левой коронарной артерии. Ложная аневризма левого желудочка также может быть следствием ошибок при протезировании митрального клапана.
Патофизиология
Развитие истинной аневризмы левого желудочка протекает в две основных фазы: ранней дилатации и позднего ремоделирования. Истинная аневризма левого желудочка (по крайней мере, в 88%) развивается обычно после трансмурального инфаркта миокарда вследствие тромбоза передней межжелудочковой ветви ( ПМЖВ) и недостаточного развития коллатерального кровообращения.
Фаза ранней дилатации
Фаза ранней дилатации у 50% пациентов начинается с момента инфаркта миокарда в течение 48 часов. У остальных пациентов формирования аневризмы происходит в течение 2 недель после инфаркта миокарда. В течение нескольких дней внутренняя поверхность развивающейся аневризмы теряет трабекулярность и становится гладкой, у 50% пациентов формируется тромб левого желудочка. На 2-3 сутки в зону инфаркта происходит миграция лейкоцитов, что приводит к лизису некротических миоцитов на 5-10 день после инфаркта. В результате разрушения коллагена и миоцитов прочность стенки миокарда к этому времени значительно снижается и возможен разрыв миокарда. Сохранение гибернирующего миокарда в периинфарктной зоне обязательное условие предотвращения развития истинной аневризмы левого желудочка.
Потеря систолической активности в инфарцированной зоне при сохранении сократительной способности в окружающем миокарде вызывает систолическое выпячивание утончение региона миокарда. Согласно закону Лапласа (T = Pr/2h), при постоянном давлении в левом желудочке (P), увеличении радиуса искривления (r) и уменьшении толщины стенки левого желудочка (h) в инфарктной зоне увеличивается напряжение стенки (T). По отношению к нормальному поврежденный (инфарцированный) миокард более пластичен и подвержен деформации. Таким образом, увеличенное систолическое и диастолическое напряжение стенки левого желудочка приводит к прогрессивному расширению инфарктной зоны, пока формирование рубца не уменьшает пластичность области аневризмы.
Вследствие роста диастолического напряжения и преднагрузки, а также увеличения уровня эндогенных катехоламинов, непораженные области миокарда вынуждены развивать усиление сокращения, что приводит к гипертрофии миокарда. Это в свою очередь вызывает рост потребления кислорода здоровыми отделами миокарда и левого желудочка в целом.
В дополнение к этому при формировании аневризмы происходит снижение ударного объема, так как часть его выбрасывается не в аорту, а в аневризму. Чистая механическая эффективность левого желудочка (внешняя ударная работа минус миокардиальное потребление кислорода) снижается, уменьшая внешнюю ударную работу и еще более увеличивая миокардиальное потребление кислорода. Аневризма левого желудочка вызывает не только систолическую, но и диастолическую дисфункцию желудочка. Диастолическая дисфункция является следствием увеличенной жесткости фиброзной аневризматической стенки, которая препятствует диастолическому заполнению и увеличивает конечно-диастолическое давление левого желудочка.
Фаза позднего ремоделирования
Начинается спустя 2-4 недели после инфаркта миокарда, когда появляется высоко васкуляризированная грануляционная ткань, которая замещается через 6-8 недель волокнистой фиброзной тканью. Аритмии, типа желудочковой тахикардии могут развиться в любое время развития желудочковой аневризмы, так как в области периинфарктной зоны развиваются микроочаги re entry. Терапия нитратами в течение только 2 недель после инфаркта не предотвращает формирование аневризмы. До настоящего времени неясна роль ингибиторов ангиотензин-конвертирующего фермента поскольку они подавляют развитие желудочковой гипертрофии. Реваскуляризация миокарда улучшая коронарную перфузию и перемещение фибробластов в инфарктную область миокарда, является хорошим профилактическим фактором развития аневризм левого желудочка. Применение стериодов, наоборот, может увеличить вероятность формирования аневризмы.
Роль матриксных металлопротеиназ в развитии постинфарктной аневризмы левого желудочка
Несмотря на значительные достижения в молекулярной, биомеханической, генетической, нейро-гуморальной и фармакологической областях, понимания строения и функции кардиомиоцита, не следует, однако, забывать тот фундаментальный факт, что высокоспециализированные клетки могут эффективно функционировать лишь в окружении коллагенового остова, который не только располагает их друг относительно друга, но и связывает кардиомиоциты. Таким образом, создается совокупность морфологических единиц, способных к генерации силы в пределах определенного структурного расположения – мышечной ленты, и к трансформации простого укорочения сократительных единиц в механически эффективное сокращение и расслабление спиральной структуры целого миокарда левого желудочка сердца.
Любое улучшение функции миоцитов в отсутствие адекватного коллагенового каркаса, и, соответственно, улучшение систолической и диастолической функции всего сердца, невозможно. Существует общепринятое мнение, что коллаген играет важную роль в поддержке размеров и формы сердца, а также в постинфарктном ремоделировании. Он составляет от 1% до 4% всех сердечных белков. Коллагеновые волокна – это надмолекулярные образования, которые состоят из молекул коллагена, уложенных зигзагообразно и перекрещенных для увеличения прочности. Внеклеточный матрикс представлен вязкоупругим окружением из коллагена типа I и III, который связывает миоциты, определяет взаимодействие между миофиламентами и поддерживает взаимоотношение капилляров и миоцитов. Коллагеновый остов состоит из сети миофибрилл и межклеточных «распорок», которые связывают соседние миоциты, что позволяет миофибриллам оптимизировать развитие мышечного усилия, распределить его внутри желудочковых стенок и предотвратить деформацию саркомеров. Внутри вышеописанной структуры межклеточное пространство заполнено протеогликанами.
Ремоделирование миокарда представляет адаптивный ответ сердца на длительное воздействие физиологических и патогенных факторов. При этом изменяется структура миоцитов и внеклеточного матрикса. Уменьшение перекрестных связей миокардиального коллагена было показано на животных моделях. Так как структурная поддержка, которая обеспечивается фибриллярным внутриклеточным коллагеном, является важной детерминантой формы миоцита и распределения масс, а также составляющей превращения сокращения миоцита в общий сердечный выброс, то ее потеря, из-за деградации зрелого коллагена с заменой его на вновь синтезированный со сниженным количеством перекрестных связей, может непосредственно влиять на систолическую дисфункцию и расширение полостей сердца. Изменения внеклеточного матрикса необходимы для формирования нового устройства камер сердца. Развитию фиброза, а именно увеличения количества белков внеклеточного матрикса – коллагена I и III типов, обязательно должна предшествовать деструкция коллагеновой сети. Коллаген I типа принимает участие в формировании внеклеточного матрикса фазу позднего ремоделирования, в то время как коллаген III типа – в фазу ранней экспансии. Увеличение коллагена происходит как в зоне инфаркта, так и вне ее. То есть можно говорить о том, что после локального повреждения на молекулярном уровне идет процесс ремоделирования всего сердца.
Всякое изменение внеклеточного матрикса по сути своей означает нарушение баланса между скоростями синтеза и распада белка. Будучи организованным в фибриллярную форму, внеклеточный коллаген является крайне устойчивым к разрушению протеазами, за исключением специфических коллагеназ – матриксных металлопротеиназ (ММП), основным источникам которых в сердце являются фибробласты. Синтезировать МПП могут еще и гладкомышечные клетки, эндотелий, желудочковые миоциты, а также нейтрофилы в зоне ИМ. Первоначально коллаген ММП-1 расщепляется на 2 фрагмента, которые подвергаются дальнейшему распаду под действием ММП-2 и ММП-9.
Изменения в структуре коллагена, его распределение в процессе ремоделирования зависит от регуляции ММП на трех уровнях: транскрипции, активации и ингибирования тканевыми ингибиторами металлопротеиназ (TИMMП). TИMMП представляют собой низкомолекулярные белки, которые имеют высокое сродство к каталитическому домену ММП. Таким образом TИMMП нейтрализуют деградацию коллагена. Гены, кодирующие ММП и ТИММП, расположены совместно и совместно же экспрессируются. Данная система индукции/активации ММП была найдена в сарколемме миоцитов. Она некорректно работает у пациентов с ишемической кардиомиопатией. Коллагеназы могут быть активированы посредством множества механизмов, включая фактор некроза опухолей — альфа (альфа-ФНО), свободные радикалы, инсулино-подобный фактор роста-1, трансформирующий фактор роста-1, который стимулирует пролиферацию фибробластов, катехоламины – то есть все факторы, которые имеют место при ишемии. Одним из эндогенных активаторов ММП может являться химаза (единственный фермент в ткани миокарда, конвертирующий ангиотензин I в ангиотензин II), повышенный уровень которой определялся при состояниях перегрузки давлением или объемом. Один из донаторов сульфгидрильных групп – окисленный глутатион, встречающийся в зоне миокардиальной ишемии, – тоже активирует латентные коллагеназы и вызывает быстрое разрушение коллагеновых мостиков в «ошеломленном» миокарде и в зоне инфаркта в течение 2-3 часов после окклюзии артерии, когда еще не развивается воспалительный инфильтрат.
Местный синтез альдостерона миофибробластами вызывает аутокринную стимуляцию системы ренин-ангиотензин-альдостерон. Вместе с ангиотензином II и предсердным натрийуритическим фактором альдостерон стимулирует трансляцию m-РНК коллагена I и III типов.
Еще одним моментом, требующего пристального внимания, является возможная обратимость ремоделирования внеклеточного матрикса. Недавние исследования показали, что длительное использование систем вспомогательного кровообращения обращает вспять сократительную дисфункцию и влияет на экспрессию генов на конечной стадии хронической сердечной недостаточности. Также было отмечено улучшение эхокардиографических параметров. Таким образом становиться понятно, что прекращение действия фактора, нагрузки, запускающего патологическое ремоделирование и развитие сердечной недостаточности, может привести к обратному развитию структурных и архитектурных изменений. Так как основой активации и модуляции внутриклеточных цепных реакций является механический стресс, то уменьшение последнего, соответственно, достижение контроля над экспрессией и активностью ММП, возможно лишь при использовании объем-редуцирующей хирургии и модификации желудочковой геометрии.
Естественное течение
Относительно новые исследования выявили 47-70% 5-летнюю выживаемость пациентов с аневризмами левого желудочка. Причины смерти включают аритмию в 44%, остановку сердца — 33%, инфаркт миокарда — 11% и несердечные причины — 22%.
Факторами, влияющим на выживаемость являются возраст, степень коронарной болезни, продолжительность стенокардии до предшествующего инфаркта, ишемическая митральная недостаточность, желудочковые аритмии, размер аневризмы, сократительной функции жизнеспособного миокарда, КДД левого желудочка. Раннее развитие аневризмы в течение 48 часов после инфаркта также уменьшает выживаемость.
Риск томбоэмболии для пациентов с аневризмами низок (0,35% пациенто-лет), и постоянный прием антикоагулянтов обычно не рекомендуется. Однако у 19% пациентов с видимыми эхокардиографически тромбами после инфаркта миокарда отмечены эпизоды тромбоэмболии. Мерцательная аритмия и большой размер аневризмы — дополнительные факторы риска томбоэмболии.
Разрыв хронических псевдоаневризм левого желудочка встречается реже, чем можно было ожидать. Разрыв левых желудочковых псевдоаневризм может быть наиболее вероятным в острой фазе инфаркта миокарда или при их большом размере. Желудочковые псевдоаневризмы имеют тенденцию вести себя подобно истинным аневризмам.
Клиническая картина
Стенокардия наиболее частое клиническое проявление у большинства пациентов аневризмой левого желудочка, так как более 60% из них имеют многососудистое поражение. Одышка — второй по частоте симптом. Она характерна для пациентов, когда в инфаркт миокарда вовлекается более 20% массы миокарда левого желудочка. Мерцательная или желудочковые аритмии могут привести к трепетанию желудочков, обмороку, вызвать внезапную смерть или увеличить степень стенокардии и одышки у 13 пациентов.
Диагностика
На электрокардиограмме присутствует зубец Q и подъем сегмента ST. Рентгенограмма грудной клетки может выявить увеличение тени сердца, что не является патогномоничным для аневризмы левого желудочка. Левая вентрикулография до недавнего времени была золотым стандартом для установления диагноза аневризмы левого желудочка. Диагноз ставиться на основании выявления большого, дискретного региона дискинезии (или акинезия) в области переднеперегородочной и апикальной стенок левого желудочка.
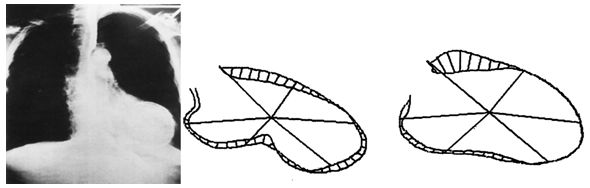
Двумерная эхокардиография — также чувствительный метод для диагностики аневризм, позволяющий не только выявить саму аневризму, но и наличие в ней тромба, а также рассчитать по сегментам локальную и глобальную фракцию выброса. Стресс ЭхоКГ дополнительно способна определить наличие и объем гибернирующих участков миокарда. Компьютерная и ЯМР томография, радионуклидная ангиография также прочно вошли в арсенал неинвазивных методов диагностики, дающих полную информацию о состоянии левого желудочка.
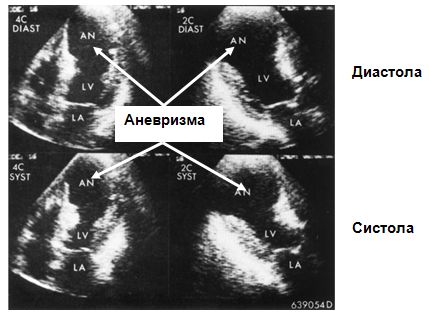
Показания к операции
Вследствие относительно хорошего прогноза для бессимптомной левожелудочковой аневризмы показания к операции относительны. Однако, у больных, подвергающихся АКШ необходимо восстановить геометрию левого желудочка. С другой стороны, для симптоматических (аритмии, стенокардия, застойная сердечная недостаточность) пациентов, операция предлагает лучший результат, чем медикаментозная терапия. Оперативное лечение абсолютно показано больным с дискинетическими (акинетическими) аневризмами при увеличении конечно-систолического индекса > 80 мл/м 2 и конечно-диастолического индекса > 120 мл/м 2 ) , а также угрозе разрыва или развития ложной аневризмы, точно так же как и при врожденных аневризмах левого желудочка. 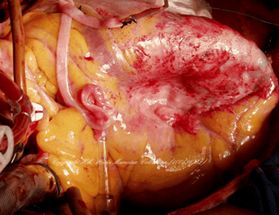
Согласно последним исследованиям, миокард представляет мышечную ленту, завернутую в спираль с определенным углом. Межжелудочковая перегородка состоит из трех мышечных слоев и вносит колоссальный вклад в выброс и присасывание крови. Диастола, как и систола, обеспечивается активным мышечным сокращением. Эффективность мышечного сокращения миокарда определяется, помимо всего прочего, определенным способом укладки его волокон и формой камеры Левого желудочка. В случае формирования аневризмы происходит нарушение нормальной геометрии левого желудочка.
Принимая во внимание описанные выше патологические изменения, вызванные постинфарктной аневризмой, становится ясно, что ее пластика является патогенетически оправданной. Теоретически, такой подход обеспечит снижение напряжения в стенке левого желудочка и снижение потребности миокарда в кислороде (на основании закона Лапласа), нивелирует перегрузку объемом и переориентирует направление мышечных волокон в более физиологическую сторону с усилением механической эффективности выброса и присасывания. Исключение из сокращения нефункционирующих сегментов и восстановление правильной ориентации миофибрилл может повысить коэффициент полезного действия базальных и средних сегментов интактного миокарда. В этой связи важным моментом операции является формирование левого желудочка в виде «готической», а не «романской» арки.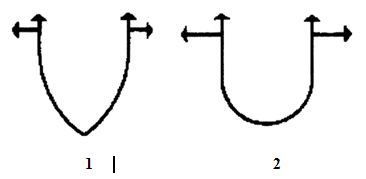
Относительные противопоказания к операции включают чрезмерный риск анестезии, отсутствие жизнеспособного миокарда вне аневризмы, низкий ( 2 ) сердечный индекс, выраженная митральная недостаточность. Глобальная фракция изгнания может быть менее полезной для оценки показаний к операции, чем сегментарная фракция изгнания оставшейся части миокарда левого желудочка.
Ангиопластика возможна только у пациентов с подходящей коронарной анатомией, одно- или двухсосудистом поражении и противопоказаниями к операции.
Техника операции
Выполняется стандартная срединная стернотомия. ИК осуществляется в режиме нормо- или умеренной гипотермии. Используется анте- и ретроградная кровяная кардиоплегия. Проводится внешняя ревизия левого желудочка для идентификации области рубца и утончения стенки. Разрез аневризмы выполняется вертикально, отступая влево от ПМЖВ на 1 см. Проводится ревизия внутренней поверхности аневризмы для определения объема резекции с учетом максимального сохранения здорового миокарда. Внутрисердечный тромб тщательно отделяется от стенки левого желудочка и удаляется.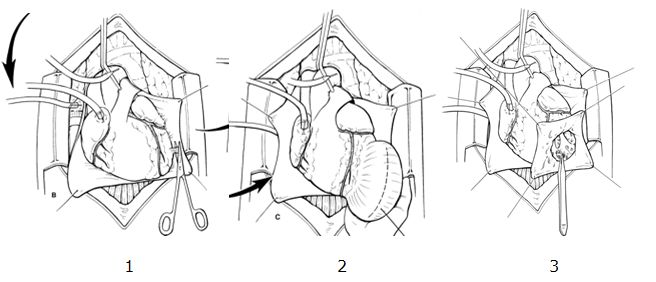
Выполняется резекция аневризмы по одному из методов, описанных ниже. Затем при необходимости проводится пластика или протезирование митрального клапана и полная реваскуляризация миокарда. Отключение аппарата ИК часто требует инотропной поддержки. Как правило, используется допамин (5 мкг/кг/мин.), а также нитроглицерин для предотвращения спазма коронарных артерий и нитропруссид натрия для снижения постнагрузки. Дополнительная инотропная поддержка не увеличивает сердечный выброс и может привести к аритмии и тахикардии. Поскольку левый желудочек плохо растяжим, ударный объем фиксирован (КДО левого желудочка ≈ 150 мл), ЧСС 90-115 уд. в мин. достаточна, чтобы поддержать сердечный индекс > 2,0 л•мин/м2. Контрпульсация может также быть необходима у пациентов со сниженной контрактильностью миокарда.
Методы ремоделирования левого желудочка
Линейная пластика (Cooley)
После удаления тромбов аневризматическая стенка резецируется, оставляя 3 см края рубца, чтобы обеспечить реконструкцию нормального левожелудочкового контура. Проленом 2� на тефлоновых прокладках накладывается двухрядный (матрацный и обвивной шов) для герметизации полости левого желудочка. 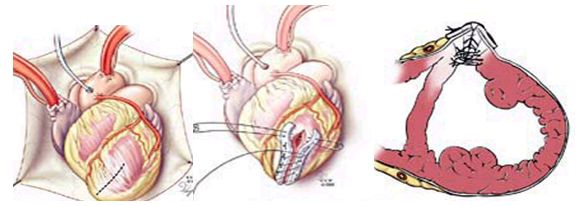
Кисетная пластика (Jatene)
Указанный способ применяется при небольших аневризмах верхушки левого желудочка. После вскрытия аневризмы по краю рубца накладывается кисетный шов 2� и затягивается. Проленом 2� на тефлоновых прокладках накладывается духрядный (матрацный и обвивной шов) для герметизации полости левого желудочка.
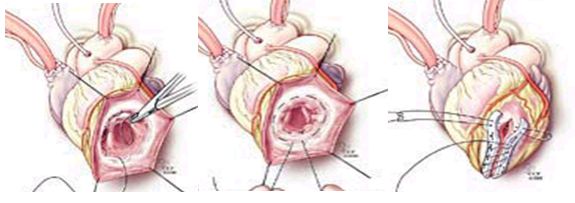
Циркулярная пластика заплатой (Cooley)
Нижние или задние аневризмы для сохранения адекватного объема полости левого желудочка обычно требуют пластики с помощью заплаты. После вскрытия аневризмы и дебридмента иссекается часть рубцовой ткани, оставляя 1 см от края здорового миокарда. Заплата из дакрона на 2 см больше в диаметре, чем отверстие в желудочке подшивается матрацными швами на прокладке, которые проводятся изнутри полости левого желудочка. Для дополнительной герметичности при необходимости первая линия шва дополняется вторам обвивным швом проленом 3�.
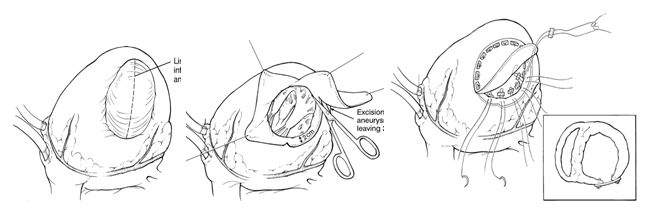
Эндовентрикулярная пластика заплатой (Dor)
В основном применяется при больших передних аневризмах левого желудочка. После вскрытия полости аневризмы и дебридмента по краю рубца накладывается кисетный шов 2� и затягивается. В дефект стенки обвивным швом 3� вшивается заплата (дакрон, ксеноперикард) 2х3 см для сохранения достаточного объема полости левого желудочка. Над заплатой простым линейным двухрядным швом сшиваются стенки аневризматического мешка.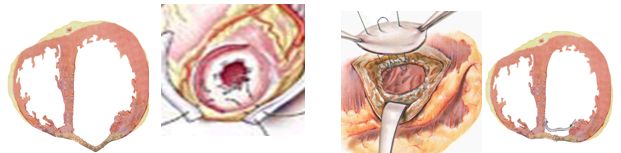
Такой вид пластики полностью сохраняет ПМЖВ для шунтирования и исключает наличие внешнего протезного материала, вызывающего спаечный процесс в перикарде. Техника V.Door также позволяет исключить аневризматическую часть межжелудочковой перегородки и может использоваться при острых инфарктах миокарда с рыхлым краем аневризмы.
Другие методы ремоделирования левого желудочка
Описанные выше методы пластики аневризмы левого желудочка имеют ряд недостатков. Так при использовании линейной пластики левого желудочка формируется длинный и тонкий желудочек с нарушенной геометрией, исключается вмешательство на МЖП, а использование прокладок и сам рубец ведут к формированию своеобразной «распорки», которая существенно затрудняет сокращение. Методы A. Jatene и V. Dor затрагивают лишь пораженный сегмент левого желудочка. A. Jatene отметил, что в некоторых случаях развивался синдром малого сердечного выброса и требовалось повторное вмешательство для увеличения объема камеры левого желудочка. M. Salati выявил развитие тяжелой диастолической дисфункции по рестриктивному типу у 8% пациентов. 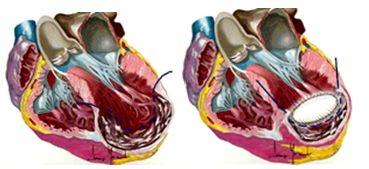
V. Dor отметил, что хорошие непосредственные результаты в дальнейшем нивелировались развитием сердечной недостаточности за счет излишнего радикализма и значительного уменьшения ударного объема и диастолического наполнения, либо за счет избыточной заплаты и увеличения миокардиального стресса. В этой связи для оптимизации объема левого желудочка V.Dor на основании изучения послеоперационных ангиограмм предложил использовать внутрижелудочковый баллон с объемом 60 мл/м 2 как модель объема полости левого желудочка. Однако, такое значение может быть слишком маленьким для пациентов, у которых до операции сердце имеет значительные размеры, поэтому, если предоперационный индекс КДО > 150 мл/м 2 , то следует добавить 15% к вышеуказанной цифре (приблизительно 70 мл/м 2 ).
В дальнейшем эта методика была развита L. Menicanti, который предложил использовать шаблон объема полости левого желудочка, представляющий собой модель левого желудочка различных типоразмеров в зависимости от площади тела пациента.
После иссечения аневризмы и введения в полость левого желудочка системы, принципиальным моментом при закрытии дефекта является использование длинной и узкой заплаты (1×4 см, а не 2×3 см, как методом V. Dor). Продольная ось вновь формируемой «шейки» при этом располагается под углом к оси вентрикулотомной раны. Фиксированная в таком положении заплата способствует восстановлению формы левого желудочка и правильной ориентации волокон миокарда. В дальнейшем, в 2002 году тот же автор предложил использовать пликацию задней стенки левого желудочка между основаниями сосочковых мышц с целью уменьшения их дисторсии и ликвидации митральной недостаточности. 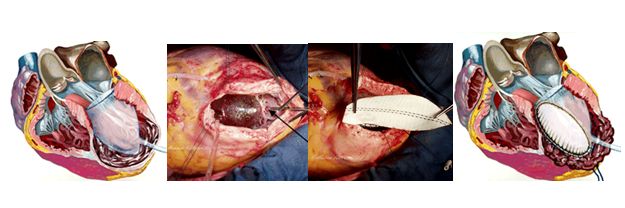
Результаты
Госпитальная летальность значительно снизилась за последние годы и составляет 3-7%. Основной причиной смерти является левожелудочковая недостаточность – 64%. Факторами риска послеоперационной летальности являются: пожилой возраст, неполная реваскуляризация миокарда, женский пол, экстренная операция, протезирование митрального клапана, фракция выброса левого желудочка 2 , среднее давление в легочной артерии > 33 мм рт.ст., уровень креатинина > 180 мг/л.
Наиболее частым осложнением в госпитальном периоде является синдром малого сердечного выброса, а также желудочковые аритмии и легочная недостаточность.
В отдаленном послеоперационном периоде улучшается функция левого желудочка: возрастает фракция выброса, уменьшается КДО и КСО левого желудочка, диастолическое наполнение и комплайнс, увеличивается толерантность к физической нагрузке. Средний класс стенокардии снижается с 3,5 до 1,2, а класс сердечной недостаточности по классификации NYHA с 3,0 до 1,7. Результаты непосредственно зависят от метода ремоделирования левого желудочка, демонстрируя явное отсутствие преимуществ линейной пластики.
5-летняя выживаемость составляет 58-80%, 10-летняя – 34-57%. 57% смертельных случаев являются следствием повторных инфарктов миокарда. Дооперационными факторами риска отдаленной летальности являются возраст, фракция выброса 20 мм рт.ст., и митральная недостаточность.
Профессор, доктор медицинских наук Ю.П. Островский
Источники: http://varikoza-med.ru/lechenie/tromb-verhushki-levogo-zheludochka/, http://lookmedbook.ru/disease/anevrizma-zheludochka-serdca, http://cardiolog.org/cardiohirurgia/operacii-na-serdce/anevrizma-levogo-jeludchka.html