Тромбоз у онкологических больных
Рак и тромбоз
Осложнение течения злокачественных новообразований тромботическими процессами замечено давно. Еще в 1865 г. Troussen сообщил о сочетании рака желудка с тромбозами вен. По его мнению, тромбофлебиты и флеботромбозы могут быть первым признаком скрыто протекающей, но не выявленной в организме злокачественной опухоли, а тромбоз сосудов вообще присущ злокачественным новообразованиям. Osier и МсCrae (1900) также наблюдали сочетание венозного тромбоза с метастазирующей карциномой желудка. М. Г. Сердюков и Б. А. Егоров (1934) описали больную, у которой спустя 2 года после операции по поводу рака матки возник тромбофлебит на фоне обширного ракового инфильтрата в малом тазу.
На секционном материале И. П. Васильев (1929) показал, что у 44 больных из 226, погибших от тромбозов и эмболии, обнаружен рак внутренних органов. О сочетании рака различных органов с тромбозом говорила также Sproul (1938). Автор выявила на вскрытиях (4528) тромбы в сердце, артериях и венах у 616 умерших, из них у 551 обнаружены злокачественные новообразования. Наиболее часто сочетание злокачественной опухоли с тромбозом сосудов было обнаружено при раке поджелудочной железы, особенно при поражении тела и хвоста этого органа (56,2%). Характерно, что на 108 больных со злокачественными и доброкачественными опухолями поджелудочной железы ни в одном случае не найдено множественных тромбозов и лишь у 20 имели место единичные тромбы в сосудах. При раке печени тромбоз наблюдался в 27,2%, раке желудка — в 21,8%, раке легких — в 14,8% случаев.
Как показывают сообщения Е. М. Тареева (1951), Е. Д. Семеновой (1955), А. А. Шелагурова (1960), Jennings и Russel (1948), Pryde (1949), Smith и Albrigt (1952), Thompson и Rodgers (1952), Strang и Walton (1953), Smith и Jates (1955) и др., осложнение рака поджелудочной железы тромбозом сосудов наблюдается довольно часто, особенно при поражении ее тела и хвоста.
О значительной частоте тромботических осложнений при злокачественных новообразованиях говорят также данные А. А. Наумовой (1961). Из 89 тромбозов различного происхождения 18 были осложнениями рака. По данным Fowler и Bollinger (1954), около 10% больных с карциномой внутренних органов погибли от тромбоэмболии легочной артерии. Anlyan с сотрудниками (1956) у 44 больных с венозными тромбоэмболиями обнаружил злокачественные новообразования. Б. П. Кушелевский и Е. Д. Шмидт (1958) установили, что около 40% венозных тромбозов приходится на злокачественные новообразования. Последние после сердечно-сосудистых заболеваний наиболее часто осложняются тромбозами и эмболиями. А. И. Струков и Н. Н. Васильева (1958) на 951 вскрытии умерших от опухолей обнаружили 160 (16,8%) тромбозов и эмболий. По их данным, наиболее часто осложняются тромбоэмболиями опухоли, локализующиеся в органах брюшной полости и малого таза (28 из 34 случаев), а из опухолей брюшной полости (17 случаев) чаще всего осложняются тромбоэмболиями опухоли желудка (12 случаев). А. В. Мельников (1960) на 216 умерших от рака желудка у 22 установил тромбоз вен, у 4 отметил сочетание тромбоза вен и артерий и у 12 — тромбозы артерий и эмболии. Из 185 больных, оперированных по поводу рака кардиального отдела желудка и пищевода, у 21 в послеоперационном периоде Ю. Е. Березов с сотрудниками (1960) отметил тромбоэмболии. Д. П. Павловский (1963) на 1600 аутопсий умерших от злокачественных новообразований тромбоз вен нашел у 91 человека, а смертельную эмболию легочной артерии — у 31. Из 83 больных с легочными эмболиями, описанными М. И. Теодори (1963), у 23 были злокачественные новообразования, из них у 9 — рак желудка. Часты тромбозы и эмболии у больных злокачественными новообразованиями также по данным М. П. Беляева (1963); из 117 больных с тромбоэмболиями у 35 были злокачественные новообразования, в том числе у 29 — рак желудка.
Особенно часто возникают тромбозы и эмболии у больных раком желудка после оперативного вмешательства (Г. М. Минц, 1936; И. Н. Ершова, 1958; В. Е. Млынчик, 1959; А. В. Мельников, 1960; А. И. Саенко, 1962; М. Л. Майзель, 1963; М. П. Беляев, 1963).
Я. Д- Бондаренко и Е. Е. Елизарова (1958) считают, что тромбофлебит нередко является маской злокачественного поражения внутренних органов. Оценку этого симптома различные авторы дают по-разному. Если А. Н. Сынчук (1956), И. Г. Туровец (1958), (1961), Т. В Бугословская, Е. С. Ром-Бугословская (1962), Rizzo (1957), Bastaroli с сотрудниками (1960), Lieberman с сотрудниками (1961) и другие видят в тромбофлебите ранний признак скрыто протекающего рака, то В. А. Германов и Е. Д. Зиновьев (1961), С. А. Малхасян (1961), James и Matheson (1935), Edwars (1949), Perlov и Daniels (1956), Anlyan и Hart (1957) и др. относят его к поздним признакам заболевания. В то же время Jennings и Russel (1948), Hubay и Holden (1954) и др. указывают, что тромбофлебит может возникнуть как в ранних, так и в поздних стадиях рака.
Рак и тромбоз: старые проблемы, новые рекомендации
До змiсту номера
Тромбоз глубоких вен нижних конечностей и тромбоэмболия легочной артерии (ТЭЛА) представляют собой наиболее опасные осложнения «естественной истории опухоли». Наличие рака в организме является основным фактором риска венозного тромбоза. За последние 50 лет смертность в течение первого месяца после хирургических операций у онкологических больных снизилась с 8,7 до 0,7%, что напрямую связано с внедрением тактики профилактического приема антикоагулянтов в до- и послеоперационном периоде.
Венозный тромбоз
Впервые это заболевание описал итальянский врач Джованни Баттиста Морганьи (1682-1771), который при вскрытии трупов нередко обнаруживал массивные венозные тромбы в легочной артерии.
Термин «эмболия» принадлежит немецкому физиологу и морфологу Рудольфу Вирхову (1821-1902). Он первым начал различать два типа тромбов: «…тот, который возникает в периферической вене и эмболизирует в легкие, и второй тип, который первично возникает в дистальных отделах легочной артерии в результате застойного кровотока». В те же годы были описаны патофизиологические механизмы формирования венозных тромбов, известные сегодня как триада Вирхова: замедление движения крови по сосудам, повреждение стенки сосуда и гиперкоагуляция.
В конце XIX века немецкий хирург Фридрих Тренделенбург для профилактики миграции тромбов из вен нижних конечностей в нижнюю полую вену предложил применять перевязку устья большой подкожной вены бедра. Несколько позже (1908) Тренделенбург попытался выполнить тромбэктомию из легочной артерии, однако успешно эту операцию смог провести только его ученик – Киршнер (1924). После этих операций в 30-е гг. ХХ века в каждой клинике Германии предписывалось иметь прикроватные хирургические наборы для экстренной тромбэктомии из легочной артерии у каждого оперированного пациента. За 10 лет было выполнено 300 подобных операций, но выжили всего 10 больных.
В 1944 г. известный хирург Альтон Ошнер в обращении к Американской хирургической ассоциации призвал проводить профилактику легочной эмболии и настаивал на том, что хирургическое лечение ТЭЛА должно отойти в прошлое.
В те годы уже имелись все условия для медикаментозной профилактики венозных тромбозов.
В 1916 г. студент Джей Мак Леан открыл первый антикоагулянт, который позже был назван гепарином. В конце 1920-х гг. Чарльз Бест (лауреат Нобелевской премии) и сотрудники его лаборатории в Университете Торонто получили очищенный гепарин. Первые клинические испытания по профилактическому использованию гепарина провел в 1935 г. Гордон Мюррей. Его работы способствовали развитию методов гемодиализа и трансплантации почки.
В 1930-х гг. Пауль Линк открыл варфарин, который широко используется в клинической практике с 1955 г. В первые 50 лет после открытия этот препарат опережал коммерческий гепарин по объему продаж.
В 1966 г. началось производство низкомолекулярных гепаринов – антитромботического препарата кальципарина.
Рак и тромбоз
Первым связь между венозным тромбозом и раком установил французский врач Арман Трюссо (1861). В своей лекции «Сочетание phlegmasia alba dolens и опухолевой кахексии» он говорил, что «при раковой кахексии состояние крови предрасполагает к ее спонтанной коагуляции». Синдром Трюссо (тромботическая маска рака) сегодня относят к паранеопластическим процессам. По иронии судьбы, через 5 лет после знаменитой лекции у самого Трюссо развился флебит, и позже был обнаружен рак желудка. Трюссо писал: «…у меня возник флебит, который просто не оставляет мне никаких сомнений относительно характера моей болезни».
Венозный тромбоз действительно сопутствует раку.
По данным V. Shen и Е. Pollak, еще 25 лет назад 1 из 7 госпитализированных онкологических пациентов умирал от ТЭЛА. Рак повышает риск тромбоэмболических осложнений в 4-6 раз, венозные тромбозы возникают у 15% онкологических пациентов. Смертность онкологических больных с тромбоэмболическими осложнениями в 2-3 раза выше по сравнению с онкологическими больными без тромбозов.
Известно, что пациенты с идиопатическим венозным тромбозом имеют повышенный риск развития рака в последующие годы. Рак, диагностированный в течение 1 года после выявления идиопатической венозной тромбоэмболии (ВТЭ), имеет более распространенную стадию и ассоциируется с худшей выживаемостью, чем недавно диагностированное онкологическое заболевание, которому не предшествовал венозный тромбоз.
До 80% послеоперационных периферических тромбозов протекают без клинических проявлений и обнаруживаются лишь с возникновением ТЭЛА или при аутопсии.
Биология рака влияет на частоту венозных тромбозов: при аденокарциноме риск выше, чем при плоскоклеточном раке. Максимальный риск возникновения тромбозов характерен для рака поджелудочной железы, опухолей головного мозга, рака яичника, матки, желудка и почки. Частота тромбозов повышена (в связи с широкой распространенностью заболевания) при раке легкого и колоректальном раке.
В то же время опухоли головы и шеи, рак молочной железы, рак предстательной железы сопровождаются более низким риском развития венозных тромбозов, и при оценке необходимости тромбопрофилактики у таких пациентов на первый план выступают другие факторы.
К венозному тромбозу у онкологических больных обычно приводят постельный режим, сдавление вен опухолью, повреждение сосуда (интравазация опухолевых клеток, химический флебит, механическое повреждение сосудов в результате терапевтических мероприятий).
Патологическая активация системы гемостаза при раке обусловлена поступлением из опухолевых клеток в кровоток высокоактивного тканевого фактора и специфических раковых прокоагулянтов. Особенно предрасположены к развитию венозных тромбозов больные с аденокарциномами, секретирующими муцин. Онкологический процесс сопровождается также повышением активности плазминогена, снижением уровня антитромбина III и естественных антикоагулянтов. Простациклин и тромбоксан также освобождаются травмированными эндотелиальными и раковыми клетками, приводя к адгезии и агрегации тромбоцитов. Цистеиновые протеазы, которые экспрессируются только раковыми клетками и амниотической тканью, способны активировать фактор Х в отсутствие фактора VIIa и запускать коагуляционный каскад. Кроме того, риск тромбозов повышается благодаря воспалительному ответу тканей и клеток на опухоль – цитокины, выделяемые в значительном количестве опухолью и клетками крови, повышают агрегацию тромбоцитов и активируют их.
В крови онкологического больного активированные тромбоциты способствуют адгезии опухолевых клеток к эндотелиальным, приводя к их миграции через стенку сосуда путем высвобождения гепараназы. При метастатической прогрессии тромбоциты находятся на поверхности циркулирующих опухолевых клеток и защищают их от повреждения клетками иммунной системы.
Серьезной причиной повышенного риска тромбозов у онкологических больных могут стать противоопухолевые лечебные мероприятия – в первую очередь обширные хирургические вмешательства и цитотоксическая химиотерапия. Повышенное тромбообразование связано с прямой органоспецифической токсичностью препаратов, повышением уровня прокоагулянтных молекул, снижением уровня эндогенных антикоагулянтов, апопотозом клеток эндотелия с высвобождением цитокинов, увеличением активности тканевого фактора, активацией тромбоцитов, моноцитов и макрофагов.
Любые хирургические вмешательства при наличии онкологических заболеваний рассматриваются как операции с высоким риском венозных тромбозов.
Принятие клинического решения о проведении медикаментозной профилактики основывается на определении физической активности пациента (госпитализация резко повышает риск осложнений), индивидуального тромботического риска, а также риска развития кровотечения.
Оценка риска тромботических осложнений
Индивидуальный тромботический риск связан с наличием одного или более факторов:
• активная опухоль или онкологическое лечение;
• снижение мобильности на ≥3 дня или потребность в постороннем уходе;
• возраст >60 лет;
• хирургическое вмешательство под общей анестезией продолжительностью >90 мин;
• ожирение (ИМТ >30 кг/м 2 );
• хирургическая операция в области малого таза или нижних конечностей продолжительностью >60 мин под общей анестезией;
• хирургическое вмешательство, ограничивающее подвижность;
• коморбидность (≥1 сопутствующих заболеваний);
• наличие острой хирургической патологии;
• протезы бедра или коленного сустава;
• перелом бедренной кости;
• венозные тромбозы в анамнезе;
• заместительная гормонотерапия или эстроген-содержащая контрацептивная терапия;
• дегидратация;
• тромбофилия;
• варикозно расширенные вены или флебиты;
• беременность или ранний послеродовой период (6 недель после родов).
Для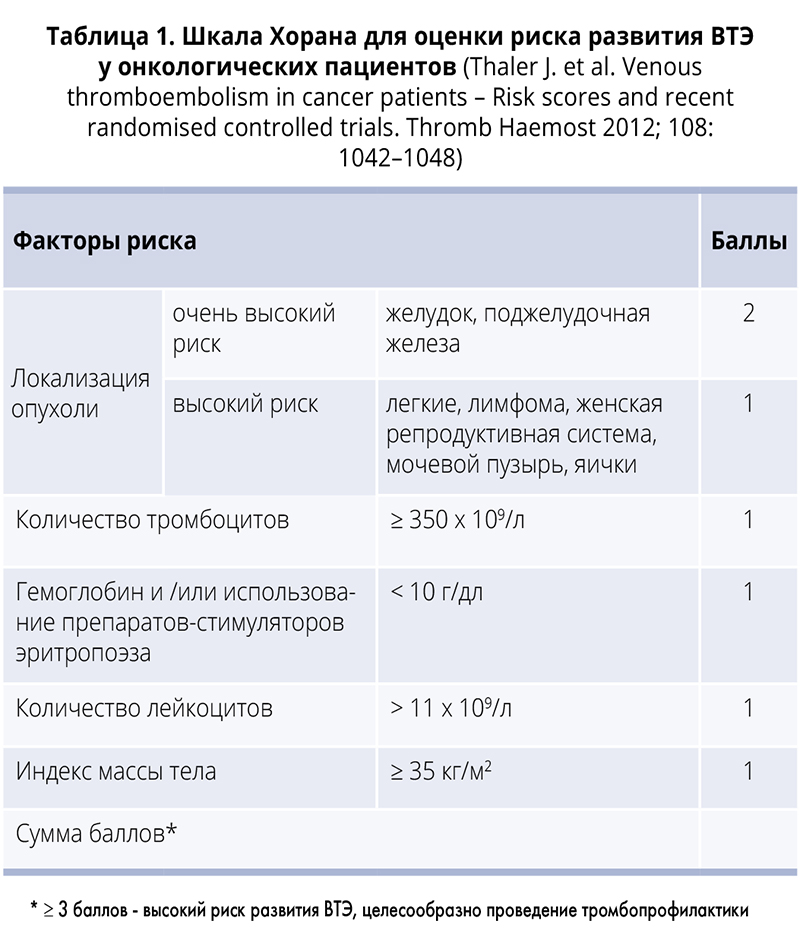 амбулаторных больных, получающих химиотерапию, степень риска венозных тромбозов определяется по шкале Хорана. Больные с карциномой поджелудочной железы и пациенты с миеломой, получающие базовую терапию, автоматически относятся к группе высокого риска (табл. 1).
амбулаторных больных, получающих химиотерапию, степень риска венозных тромбозов определяется по шкале Хорана. Больные с карциномой поджелудочной железы и пациенты с миеломой, получающие базовую терапию, автоматически относятся к группе высокого риска (табл. 1).
В рутинной практике все пациенты при поступлении в стационар должны быть оценены с точки зрения риска развития венозного тромбоза и кровотечения (шкалы Каприни и АССР). Риски регулярно оцениваются в течение 24 ч после госпитализации и, как минимум, каждые 48 ч после госпитализации.
Немаловажно, что проблема профилактики тромбозов недооценена самими врачами. В итоге тромбоз глубоких вен и ТЭЛА характеризуются прижизненной гиподиагностикой и недостаточно эффективным лечением, хотя выявляются при аутопсии у 50% больных метастатическим раком.
Фундаментальное обсервационное исследование FRONTLINE, проведенное в 2001-2003 гг., показало, что профилактику тромбоза после операций у онкологических больных проводят 50% хирургов и только 5% онкологов. Среди химиотерапевтов распространено мнение, что риск тромбообразования у онкологических больных низок.
К сожалению, в Украине еще в 2011 г. до 50% врачей считали, что для профилактики венозных тромбозов достаточно приема аспирина.
Выбор антикоагулянта и продолжительность профилактики
Современные требования, предъявляемые к антикоагулянтам в онкологической практике, включают удобный способ введения фиксированной дозы, отсутствие необходимости лабораторного мониторинга на фоне терапии, совместимость с препаратами для химиотерапии и в целом приемлемый профиль лекарственных взаимодействий, низкий риск кровотечений, а также наличие доказательной базы.
Современным требованиям соответствуют низкомолекулярные гепарины (НМГ) – биологические препараты похожего молекулярного веса (меньшего, чем в молекуле эндогенного гепарина), но обладающие индивидуальными биологическими, фармакологическими и клиническими характеристиками. Многочисленные международные рандомизированные исследования свидетельствуют о большей эффективности НМГ по сравнению с нефракционированным гепарином (НФГ), что связано с блокированием преимущественно Xа фактора свертывания крови. Способность НМГ стимулировать выход из эндотелия ингибитора пути тканевого фактора (который может секретироваться опухолью) крайне актуальна для онкологических больных. Кроме того, НМГ имеют низкий риск тромбоцитопении, отличаются высокой биодоступностью и быстрым началом действия, поскольку не связываются с клетками и белками плазмы. Препарат вводится 1-2 раза в сутки и может использоваться для профилактики и лечения венозных тромбозов в стационаре и амбулаторных условиях. Помимо всех перечисленных преимуществ, НМГ не требуют ежедневного лабораторного мониторинга, обеспечивают более предсказуемый, чем НФГ, антикоагулянтный ответ и обладают более предсказуемыми фармакокинетическими свойствами (включая клиренс и лекарственные взаимодействия). Дисфункция желудочно-кишечного тракта не влияет на подкожное введение препарата. Особенности дозирования НМГ у онкологических больных отражены в табл. 2, 3.
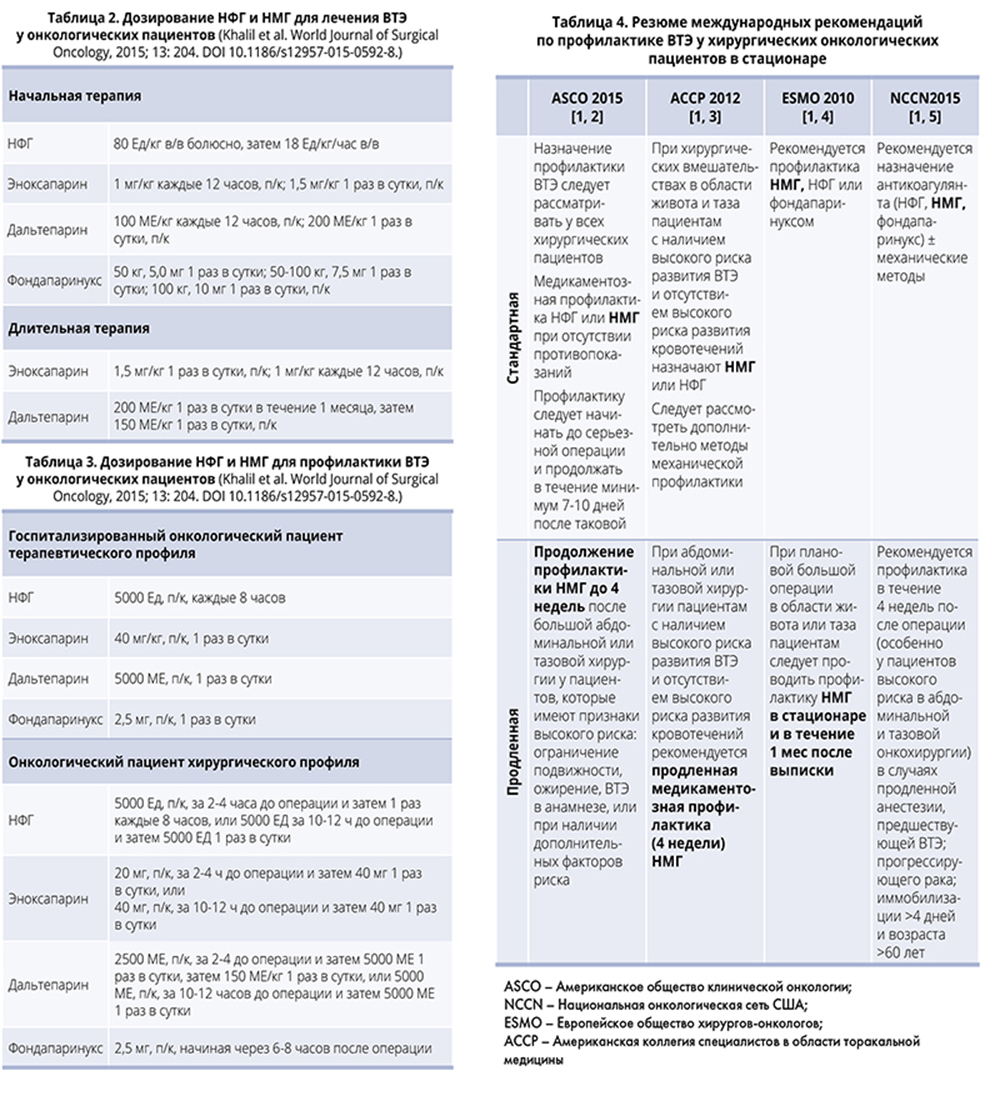
Профилактика венозных тромбозов посредством назначения НМГ проводится в обязательном порядке при госпитализации онкологического больного по поводу ургентного состояния, а также у онкологических больных, перенесших серьезные операции.
Профилактика НМГ сроком до 4 недель проводится у онкологических больных, подвергшихся тазовой или абдоминальной хирургической операции при наличии признаков высокого риска (неподвижность, ожирение, истории ВТЭ в анамнезе). Резюме международных рекомендаций по стандартной и продленной профилактике ВТЭ у хирургических онкологических пациентов в стационаре представлено в табл. 4.
Пациенты с активной формой метастазирующего рака, которым назначен тот или иной вид комбинированной противоопухолевой терапии, должны получать НМГ на протяжении не менее 6 мес. Пациенты со случайно выявленными бессимптомными тромбозом глубоких вен и ТЭЛА должны получать НМГ так же, как и при симптомных ВТЭ. При ТЭЛА мелких ветвей вопрос решается индивидуально.
Профилактика с помощью НМГ не показана амбулаторным онкологическим больным с низким тромботическим риском, а также пациентам с высоким риском кровотечения (например, при первичных опухолях головного мозга).
После выявления опухоль-ассоциированной ВТЭ монотерапию НМГ следует продолжать минимум 6 мес – как и в том случае, если у пациента имеется персистирующая злокачественная прогрессия и планируется продолжение противоопухолевой терапии. Для пациентов с низким риском рецидива спустя 6 мес антикоагулянтная терапия может быть прекращена при отсутствии активного злокачественного процесса (излечение либо ремиссия) и при условии, что они в дальнейшем не будут получать никакой противоопухолевой терапии. Лечение антикоагулянтами должно быть продолжено у пациентов с высоким риском рецидива, но с периодически повторяющейся оценкой риск/польза.
При ВТЭ, рецидивирующей на фоне приема антикоагулянтов, онкологическому пациенту должны быть назначены НМГ в терапевтической дозе, если ранее он получал препараты других групп либо НМГ в недостаточной дозе. Если осложнение возникло на фоне приема терапевтической дозы НМГ, дозу препарата следует увеличить на 25%. Кава-фильтры следует устанавливать только при наличии абсолютных противопоказаний к НМГ (например, активное кровотечение).
Таким образом, применение низкомолекулярных гепаринов у онкологических пациентов необходимо рассматривать как обязательный компонент комплексного лечения на разных этапах лечебного процесса.
Литература
1. Khalil et al. Venous thromboembolism in cancer patients: an underestimated major health problem. World J of Surg Oncology, 2015; 13: 204.
2. Lyman G.H. et al. Venous thromboembolism prophylaxis and treatment in patients with cancer: American society of clinical oncology clinical practice guideline update 2014. J Clin Oncol, 2015; 33: 654-656.
3. Gould M.K. et al. Prevention of VTE in nonorthopedic surgical patients: antithrombotic therapy and prevention of thrombosis, 9th ed: American college of chest physicians evidence-based clinical practice guidelines. Chest, 2012; 141(Suppl): e227s-e277s.
4. Mandala M. et al. Venous thromboembolism in cancer patients: ESMO clinical practice guidelines for the management. Annals of Oncolog, 2010; 21(Supp l.5): v274-v276.
5. Streiff M.B. et al. Cancer-Associated Venous Thromboembolic Disease, Version 1.2015. J Natl Compr Canc Netw, 2015; 13(9): 1079-95.
6. Kakkar A.K. et al. Venous thrombosis in cancer patients: insights from the FRONTLINE survey. Oncologist, 2003; 8(4): 381-8.
7. Shen V.S., Pollak E.W. Fatal pulmonary embolism in cancer patients: is heparin prophylaxis justified? South Med J, 1980 Jul; 73(7): 841-3.
Спеціальний випуск тематичного номеру газети «Здоров’я України» «Онкологія, гематологія, хіміотерапія» 2017 р.
СТАТТІ ЗА ТЕМОЮ Онкологія та гематологія
За ініціативи Національного інституту раку (НІР) щороку проводиться конференція, присвячена хірургічному лікуванню пухлин шлунково-кишкового тракту. Цього року вирішено виокремити тематику гепатопанкреатобіліарної хірургії, що продиктовано великою зацікавленістю спеціалістів цією проблемою. Захід об’єднав провідних науковців і лікарів-практиків у галузі онкології та хірургії з України, США, Італії, Німеччини та Швеції.
Согласно статистическим данным, в 2012 году в мире зарегистрировано 238 719 новых случаев рака яичника (РЯ) и 151 917 (63,6%) случаев смерти от данной патологии. По прогнозам, в 2020 году во всем мире будет зарегистрировано до 190 000 новых случаев РЯ. В Украине, согласно данным Канцер-реестра, в 2015 году выявлено 3477 новых случаев РЯ и 1862 (53,5%) случаев смерти от РЯ. Выделяют эпителиальные и неэпителиальные типы РЯ. Эпителиальные опухоли составляют более 90% всех случаев РЯ. .
У рамках VIII науково-практичної конференції «Перспективи діагностики та лікування гематологічних захворювань» особливу увагу привернуло секційне засідання, присвячене проблемним питанням тромбоцитопенії. На засіданні були розглянуті різні аспекти тромбоцитопенії, а також наявні терапевтичні можливості, серед яких особливе місце займає рекомбінантний людський тромбопоетин (рлТПО). .
21-22 травня в м. Києві відбувся міжнародний науковий симпозіум «Фундаментальні засади біотерапії злоякісних новоутворень», організований Інститутом експериментальної патології, онкології і радіобіології (ІЕПОР) ім. Р.Є. Кавецького Національної академії наук України (НАНУ). Симпозіум був присвячений фундаментальним дослідженням, прикладним аспектам, сучасному і майбутньому використанню протипухлинних вакцин. Він проводився у рамках проекту TWINNING VACTRAIN (використання протипухлинних вакцин на базі ДНК), який отримав підтримку з програми досліджень та інновацій Європейського Союзу «Горизонт-2020». .
poliklinika03
поликлиника03 — доступная медицинская информация для всех
среда, 8 апреля 2009 г.
Тромбоэмболические осложнения у онкобольных
 Нарушения свертывающей системы крови и их последствия (тромбозы и геморрагии) – одна из основных причин смерти среди пациентов с опухолевыми заболеваниями. Если сепсис и прогрессия опухоли стабильно возглавляют реестр непосредственных причин гибели больных с неоплазиями, то тромбозы и тромбоэмболии обосновались на третьем месте. В качестве профилактики нарушений системы гемостаза и связанных с ними тромбоэмболических осложнений у больных с новообразованиями широко используется гепарин. Наиболее эффективными считаются низкомолекулярные гепарины (НМГ), которые обладают высокой биодоступностью и в гораздо меньшей степени вызывают тромбоцитопению, индуцированную гепарином. По данным многоцентровых исследований, профилактика НМГ снижает частоту послеоперационных венозных тромбозов в 10-12 раз.
Нарушения свертывающей системы крови и их последствия (тромбозы и геморрагии) – одна из основных причин смерти среди пациентов с опухолевыми заболеваниями. Если сепсис и прогрессия опухоли стабильно возглавляют реестр непосредственных причин гибели больных с неоплазиями, то тромбозы и тромбоэмболии обосновались на третьем месте. В качестве профилактики нарушений системы гемостаза и связанных с ними тромбоэмболических осложнений у больных с новообразованиями широко используется гепарин. Наиболее эффективными считаются низкомолекулярные гепарины (НМГ), которые обладают высокой биодоступностью и в гораздо меньшей степени вызывают тромбоцитопению, индуцированную гепарином. По данным многоцентровых исследований, профилактика НМГ снижает частоту послеоперационных венозных тромбозов в 10-12 раз.
Тромбозы и тромбоэмболии у больных с новообразованиями обусловливают еще одну проблему – материальные затраты, связанные с необходимостью госпитализации пациентов и проведения интенсивной, порой дорогостоящей терапии. Почему тромбозы так серьезно осложняют течение онкологических заболеваний? Свою точку зрения на эту проблему в докладе на Российском национальном конгрессе «Человек и лекарство» представил, доктор медицинских наук, профессор В.В. Птушкин.
Причины тромбоэмболий при неоплазии
Тромбозы и эмболии – одна из ведущих причин смерти больных с опухолевыми заболеваниями. Учеными было выявлено несколько основных направлений активации прокоагулянтного гемостаза у пациентов с опухолями:
•гиперэкспрессия VII фактора гемостаза, активирующего начальные этапы свертывающей системы;
•способность опухоли высвобождать прокоагулянтную субстанцию;
•активация свертывающей системы в ответ на стимуляцию иммунной системы.
На любую опухоль организм реагирует, как на чужеродную ткань, пытаясь ее элиминировать. Активация иммунной системы приводит к выбросу провоспалительных цитокинов (интерлейкина 1, VII фактора свертывания крови, фактора некроза опухолей), которые создают «идеальную» тромбогенную поверхность эндотелия.
Наряду с опухолями, при которых частота тромбоэмболических осложнений резко возрастает, существуют также опухоли, не приводящие к тромбообразованию. Прогрессии тромбоза способствуют гормонотерапия (в частности, длительная антиэстрогенотерапия), цитостатическая терапия, повреждающая как опухолевые клетки с выходом прокоагулянтных субстанций в кровоток, так и эндотелий сосудов со снижением выработки антикоагулянтов и высвобождением субэндотелиальных структур (коллагена, эластина), активирующих тромбоциты и белки свертывания. В значительной мере увеличивают риск тромбоза установка постоянных сосудистых катетеров и оперативные вмешательства. Вышеуказанные воздействия, повышая тромбоэмболическую готовность, способны существенно увеличивать летальность пациентов в группах наибольшего риска.
Риск повышения активности тромбообразования возрастает прямо пропорционально степени распространения опухолевого процесса. Сам факт обнаружения тромба у пациента с опухолевым заболеванием повышает риск его смерти в течение 6 месяцев на 60%. Это статистически значимо снижает медиану общей выживаемости в группе больных с распространенными опухолями и тромботической болезнью.
Тромбоэмболические осложнения часто возникают вследствие активации плазменного звена гемостаза. Пациенты с неоплазиями имеют повышенный уровень активированных форм факторов VIII и XII, а также маркеров коагуляции. Выброс в кровеносное русло липосахаридов из разрушающихся мембран опухолевых клеток может активировать тромбоциты, которые, в свою очередь, генерируют тромбоцитарный фактор V и фосфолипиды, необходимые для активации X фактора свертывания. Эти изменения чрезвычайно распространены и по некоторым данным встречаются у 90% больных с неоплазиями. Доказательством клинической значимости активации свертывания являются посмертные исследования, выявляющие венозные тромбозы и тромбоэмболии легочной артерии у 50% пациентов.
Патогенез активации свертывания крови у больных с опухолевыми заболеваниями многообразен. Среди факторов, способствующих этому процессу, следует отметить выделение опухолевыми клетками тканевого тромбопластина и опухолевого прокоагулянта. Так, муцинозные аденокарциномы выделяют секрет, содержащий сиаловые кислоты и способный активировать фактор X. Специфическое поражение печени нередко сопровождается снижением синтеза протеинов C и S, оказывающих антитромботическое действие. При раке часто повышено содержание некоторых провоспалительных цитокинов (интерлейкина 1, фактора некроза опухоли, интерферона γ), способных повреждать эндотелий. Сам по себе рост опухоли может создавать условия для тромбообразования за счет замедления кровотока при сдавливании сосудов и их инфильтрации.
Антикоагулянты
Переходя к лечению, отметим несколько классов противотромботических препаратов, способных предотвращать образование или лизировать внутрисосудистые тромбы. В первую очередь это прямые (гепарины, гирудин, синтетические антитромбины) и непрямые (антивитамины К – варфарин, кумарин) антикоагулянты, препятствующие образованию фибрина. Ко второму классу относят средства, предотвращающие активацию тромбоцитарного звена гемостаза, или антиагреганты (ацетилсалициловая кислота, дипиридамол, клопидогрель). В третью группу входят тромболитики (урокиназа, тканевый активатор плазминогена) – ферментные препараты, способные лизировать волокна фибрина и вызывать разрушение образовавшихся тромбов.
Пожалуй, наиболее важными из этого списка являются прямые антикоагулянты, в частности гепарины, которые оказывают быстрое и выраженное антикоагулянтное действие, образуя комплекс с белком плазмы антитромбином и вызывая его конформационные изменения, ведущие к тысячекратному усилению способности блокировать ключевой фермент каскада свертывания крови – тромбин. Тромбин, как известно, непосредственно реагирует с фибриногеном крови, превращая этот растворимый белок в нерастворимый полимер фибрин – основу тромба. Кроме того, комплекс гепарин-антитромбин в той или иной мере инактивирует другие важные энзимы каскада свертывания, в частности активированный фактор Х, который, находясь в области слияния внешнего и внутреннего каскадов свертывания крови, в комплексе с активированным фактором V, фосфолипидами и ионами кальция превращает неактивный протромбин в активный тромбин. Такое положение фактора Х делает его стратегическим регулятором активности тромбина. Гематологи отмечают еще один важный компонент антикоагулянтной активности гепарина – повышение высвобождения эндотелиальными клетками ингибитора тканевого фактора свертывания.
Низкомолекулярные гепарины в онкологии
У всех больных с умеренным риском необходимо профилактическое применение прямых антикоагулянтов. Традиционным является подкожное введение низких доз (5000 ЕД ґ 2-3 раза в день) обычного нефракционированного гепарина (НФГ). Между тем, НФГ обладает рядом существенных недостатков: низкая биодоступность (не превышает 29% при подкожном введении) 22 , малопредсказуемый антикоагулянтный эффект, гепарининдуцированная тромбоцитопения 23 . Гепарины, произведенные различными заводами, очень сильно различаются по своим фармакокинетическим параметрам, поэтому эффект от применения того или иного гепарина часто бывает непредсказуем. Кроме того, для достижения оптимального действия нефракционированного гепарина необходима внутривенная инфузия препарата с подбором доз под контролем АЧТВ, что значительно усложняет лечение и увеличивает его стоимость, снижает качество жизни пациента 24-29 .
В настоящее время в международной клинической практике предпочтение отдается низкомолекулярным гепаринам (НМГ), т.к. многочисленные исследования показали, что они оказывают хороший профилактический эффект, применять их удобнее, а число геморрагических осложнений ниже. При умеренном риске широко используют малые дозы НМГ : 20 мг (0,2 мл) клексана (эноксапарин натрия) 1 раз в сутки под кожу живота, либо 2500 МЕ фрагмина (дальтепарин натрия) 1 раз в сутки либо 0,3 мл фраксипарина (надропарин кальция) 1 раз в сутки. Введение НМГ начинают до операции и продолжают в течение 7-10 дней до полной мобилизации больного. Ингибирующая активность в отношении Хафактора Клексана продолжается в течение 24 часов после однократной инъекции, у Фрагмина и Фраксипарина — 17 часов, что еще раз подтверждает утверждение о том, что низкомолекулярные гепарины не являются взаимозаменяемыми. Альтернативной рекомендацией у больных умеренного риска может быть перемежающаяся пневматическая компрессия, которую нужно начинать на операционном столе и продолжать постоянно до исчезновения необходимости постельного режима.
В настоящее время появляется все больше доказательств того, что сочетание фармакологической профилактики и эластической компрессии еще больше снижает частоту венозного тромбоза у больных в этой группе риска. Эта комбинация особенно целесообразна у пациентов с варикозным расширением вен нижних конечностей 30 .
Всем больным с высоким риском в обязательном порядке должна проводиться профилактика. При этом, дозировку антикоагулянтов следует увеличить. Рекомендуемые дозы НФГ — не менее 5000 ґ 3 раза в сутки или дозы, подобранные под контролем АЧТВ, причем этот показатель должен повышаться в 1,5-2 раза. Бесконтрольное увеличение доз НФГ существенно увеличивает частоту геморрагических осложнений.
Дозы НМГ также требуют увеличения. Клексан вводят по 40 мг (0,4 мл) 1 раз в сутки, Фрагмин по 5000 МЕ 2 раза в сутки, Фраксипарин — 0,4 мл первые 3 дня, затем по 0,6 мл в сутки (при массе тела пациента более 70 кг), под кожу живота. При этом контроля АЧТВ не требуется
Профилактика тромбоэмболических осложнений
Прежде чем рассмотреть профилактические мероприятия, отметим, что оперативные вмешательства у больных с неоплазиями увеличивают вероятность тромбоэмболических осложнений. Длительная иммобилизация больных, вызывающая стаз крови и выброс тканевого тромбопластина в кровоток при иссечении тканей, значительно активирует систему свертывания. По мнению некоторых специалистов, операции с промежуточным или низким риском тромбозов или тромбоэмболий у больных с опухолями следует относить к категории высокого риска этих осложнений, сопоставимого с ортопедическими вмешательствами. Для этой группы пациентов стандартом считается профилактическое применение гепарина.
Больные с опухолевыми заболеваниями, у которых уже отмечались тромбозы, имеют крайне высокий риск рецидивов этих осложнений, поэтому им часто проводят вторичную противотромботическую профилактику. При этом терапию, как правило, начинают с применения гепарина и в дальнейшем, если есть необходимость продолжительного поддержания гипокоагуляционного состояния крови, назначают непрямые антикоагулянты перорально. Эта методика хорошо зарекомендовала себя у больных, не имеющих опухолей, с высоким риском тромбозов. В то же время больные с неоплазиями представляют собой особую группу с точки зрения как эффективности, так и токсичности стандартных методов лечения и профилактики тромбоэмболических осложнений. Общая эффективность первичной и вторичной противотромботической профилактики у них, как правило, ниже, а частота геморрагических осложнений выше, чем у больных в общей популяции. Профилактическое назначение непрямых антикоагулянтов у больных с неоплазиями менее эффективно.
Кроме того, терапия непрямыми антикоагулянтами может осложняться лекарственными взаимодействиями, а рвота, нарушения питания и опухолевое или метастатическое поражение печени приводят к непредсказуемым колебаниям концентрации этой группы препаратов. Необходимость экстренных оперативных вмешательств повышает риск осложнений в связи с противосвертывающим эффектом, сохраняющимся 2-3 дня после отмены непрямых антикоагулянтов. Проведение химиотерапии, осложняющейся тромбоцитопенией и диктующей необходимость прерывания противосвертывающей терапии, требует постоянного лабораторного контроля уровня гипокоагуляции, что не всегда удобно у больных с ограниченным венозным доступом. Альтернативой непрямым антикоагулянтам могут стать НМГ, которые имеют благоприятный профиль лекарственных взаимодействий и могут эффективно применяться у больных, резистентных к терапии антивитаминами К. Можно сделать вывод о большей эффективности НМГ в профилактике повторных тромбоэмболических осложнений у больных с опухолевыми заболеваниями по сравнению с непрямыми антикоагулянтами без повышения риска геморрагических осложнений.
Профилактическое назначение антикоагулянтов у этой категории больных следует сочетать с механическими мерами ускорения венозного кровотока в нижних конечностях (например, перемежающейся пневмокомпрессией).
Профилактику следует начинать до операции во всех группах риска, так как примерно в половине случаев ТГВ( тромбоз глубоких вен) начинает формироваться уже на операционном столе. Первая доза НФГ должна быть введена за 2 часа до начала хирургического вмешательства. НМГ больным из группы умеренного риска также вводят за 2 часа до операции. При высоком риске развития тромбоза (например, у ортопедических больных) НМГ в более высокой дозе вводят за 12 часов до операции.
В ургентной хирургии, а также в случаях опасности значительного интраоперационного кровотечения, гепаринотерапия может быть начата после завершения хирургического вмешательства, но не позже, чем через 12 часов. В этом случае необходимо применять более высокие дозы НМГ.
Во время операции в таких случаях целесообразно использование средств ускорения венозного кровотока. Применяются также низкомолекулярные декстраны, однако, убедительных литературных данных, подтверждающих их эффективность для профилактики послеоперационных тромбозов, не имеется.
Сочетание спинальной или эпидуральной анестезии с профилактическим назначением НМГ является, видимо, одним из наиболее эффективных способов предотвращения послеоперационных тромбоэмболических осложнений. Вместе с тем оно несет в себе определенную опасность развития спинальной гематомы. Вот почему в таких случаях необходимо соблюдать определенные правила: 1) спинальная пункция возможна только через 10-12 часов после начальной профилактической дозы НМГ; 2) необходимо удалить, если возможно, спинальный катетер перед началом введения антикоагулянтов; 3) если катетер остается на месте, его удаляют через 10-12 часов после последней дозы НМГ и за 2 часа до следующей; 4)следует отложить применение антикоагулянтов при травматичной спинальной/эпидуральной пункции; 5)необходимо соблюдать осторожность при применении нестероидных противовоспалительных средств на фоне использования НМГ и регионарной анестезии (рекомендации FDA США).
Профилактически антикоагулянты после операции должны назначаться в течение не менее 7 -10 дней, их введение необходимо вплоть до полной мобилизации пациента. В ряде случаев (после остеосинтеза и ортопедических вмешательств), по данным литературы, риск развития тромбозов сохраняется до 35 дней. 32 Следует обсудить вопрос о продлении профилактики, когда госпитализация удлиняется или сохраняется риск развития тромбоэмболических осложнений после выписки пациента из стационара. Профилактическое введение НФГ и НМГ отменяют без назначения непрямых антикоагулянтов.
Необходимость длительной (в течение нескольких месяцев) фармакологической профилактики может потребовать использования непрямых антикоагулянтов (варфарин, синкумар или фенилин). Их применение в ближайшем послеоперационном периоде не оправдано из-за недостаточной эффективности фиксированных малых доз и высокой частоты геморрагических осложнений при лечебной дозировке (международное нормализованное отношение — МНО* — 2,0-2,5) 31 . В то же время подобный режим антикоагулянтной профилактики вполне осуществим в отдаленном послеоперационном периоде. Вопросы оптимальной продолжительности профилактического назначения антикоагулянтов при различных операциях (особенно после протезирования суставов, остеосинтеза и проведения послеоперационной химиотерапии при онкологических заболеваниях) требуют дальнейшего изучения, хотя зарубежными исследователями уже доказана клиническая эффективность продолжительного применения (до 30-35 дней) эноксапарина при артропластике тазобедренного сустава. Использование малых доз аспирина в качестве дезагреганта является эффективной мерой предотвращения артериального ретромбоза. В отношении ТГВ профилактический эффект его также зарегистрирован, однако он существенно уступает таковому при использовании антикоагулянтов и даже — эластической компрессии 33 .
В настоящее время проводят исследования новых классов антикоагулянтов: пентасахарида (который непосредственно связывается с АТIII), синтетических аналогов гирудина и других прямых ингибиторов тромбина (в том числе и препаратов энтерального приема). Их профилактическая эффективность и безопасность пока недостаточно изучены.
Больные с высоким риском кровотечений, как вследствие нарушений свертывания крови, так и из-за специфических хирургических процедур, должны получать механические методы профилактики.
Источники: http://www.medical-enc.ru/4/gemostaz/rak-i-tromboz.shtml, http://health-ua.com/article/31230-rak-i-tromboz-starye-problemy-novyerekomendatcii, http://poliklinika03.blogspot.com/2009/04/blog-post_3464.html