Артериальное давление перфузионное давление
Артериальное давление, перфузионное давление глаза и открытоугольная глаукома у пациентов с системной гипертензией
Директор по развитию специализированного центра восстановления зрения ОПТИМЕД, врач Александр Нелин прокомментировал статью «Артериальное давление, перфузионное давление глаза и открытоугольная глаукома у пациентов с системной гипертензией», которая была опубликована группой авторов Cantor E, Mendez F, Rivera C, Castillo A and Martinez-Blanco A:
«Исследование, проведенное группой авторов (Cantor E, Mendez F, Rivera C, Castillo A and Martinez-Blanco A) in Колумбии, меня заинтересовало. Целью данного исследования было оценить взаимосвязь между артериальным давлением (BP), перфузионным давлением глаза (OPP) и возникновением первичной открытоугольной глаукомы (POAG) у пациентов с системной гипертензией
Это исследование было проведено в шести городах Колумбии. Участники исследования – пациенты с гипертонической болезнью — прошли полное офтальмологическое обследование. Измерение внутриглазного давления было проведено с помощью тонометрии Голдмана. Диагноз «глаукома» был подтвержден фотографиями визуального поля и зрительного нерва. Для оценки образа жизни и здоровья участников использовались интервью и анкеты. Для оценки взаимосвязи между артериальным давлением (BP), перфузионным давлением глаза (OPP) и наличием или подозрением на наличие первичной открытоугольной глаукомы (POAG) использовался метод многокомпонентной логистической регрессии.
В исследовании приняли участие 1 272 человека. В результате исследования авторы получили следующие результаты: у 131 участника (10,3%) были диагностированы подозрения на глаукому, а у 65 участников (5,1%) диагноз глаукома был подтвержден. Высокие значения диастолического артериального давления (> 90 мм рт. ст.) и низкие значения перфузионного давления глаза ( prm@optimed.by
+375 (44) 549-5-179
+375 (25) 549-5-179
+375 (29) 549-5-179
+375 (17) 266-33-03
Мы в социальных сетях:
© 1998-2017 ООО «МИР МЕДИЦИНЫ»
УНП 190526867 УНП 500833041.
Лиц. МЗ РБ № М-2728 от 30.06.2014г. до 30.06.2024г.
Свидетельство о гос.регистрации № 190526867, выдано Минским городским исполнительным комитетом на основании решения № 653 от 31.03.2004г.
NSICU.RU neurosurgical intensive care unit
сайт отделения реанимации НИИ им Н.Н. Бурденко
Курсы повышения квалификации

Асинхронии и графика ИВЛ

Водно-электролитные
нарушения
в нейрореанимации

Книга «Основы ИВЛ»

Рекомендации
по интенсивной терапии
у пациентов
с нейрохирургической патологией
Статьи → Мониторинг церебрального перфузионного давления в интенсивной терапии
НИИ Нейрохирургии Бурденко, РАМН, Москва
Общеизвестно, что церебральное перфузионное давление (ЦПД) определяется как разница между средним артериальным (САД) и средним внутричерепным давлениями (ВЧД): ЦПД = САД – ВЧД и измеряется в миллиметрах ртутного столба (мм рт.ст.).
Очень часто клиницисты путают понятия ЦПД и перфузия головного мозга. Что же такое перфузия и почему давление называется перфузионным?
Перфузия – это процесс прохождение крови через ткань или орган. Перфузию оценивают как отношение потока жидкости сквозь ткань к массе этой ткани. В нашем случае перфузия – это отношение объемного мозгового кровотока к массе мозгового вещества. Она измеряется в миллилитрах крови на 100 гр. ткани в минуту (мл/ 100 г/ мин). Усредненный объемный мозговой кровоток в физиологических условиях приблизительно равен 50 мл/100г/мин. Существуют региональные отличия для серого и белого вещества мозга, которые варьируют от 70 до 20 мл/100г/мин., соответственно. Нижние границы мозгового кровотока, при которых развиваются гипоперфузия и церебральная ишемия, хорошо изучены и установлены в экспериментальных работах: мозговой кровоток менее 30мл/100г/мин вызывает развитие неврологической симптоматики и изменение функциональной активности нейронов; при снижении до 15-20 мл/100 г/мин развиваются обратимые нарушения на уровне дисфункции мембран нейронов; при снижении кровотока менее 10-15 мл/100г/мин развивается необратимые нейрональное повреждение и гибель нейронов [1;9;10;32]. Однако, следует помнить, что развитие деструктивных морфологических изменений в мозговой ткани зависит не только от степени, но и от длительности ишемии [11;32].
В гидродинамике, как и в электродинамике для расчета силы тока (жидкости или электричества) используется закон Ома I=U/R. В электродинамике – это отношение напряжения или разности потенциалов к сопротивлению, а в гидродинамике – это отношение разности давлений в начале и конце трубки, или системы трубок, к сопротивлению. Таким образом, объемная скорость жидкости прямо пропорциональна разнице давлений и обратно пропорциональна гидродинамическому сопротивлению. Разность давлений, или градиент давлений, создающий поток крови через ткань и называют перфузионным давлением. В тканях организма перфузионное давление определяется градиентом давлений между артериальным и венозным руслом. В клинической практике мы используем ЦПД, как суррогатный показатель перфузии мозга, в виду отсутствия других доступных методов измерения. В соответствии с законом Ома перфузия мозга, или объемный мозговой кровоток, описывается формулой CBF = СРР / CVR, где CBF- объемный кровоток, СРР — церебральное перфузионное давление, CVR- сопротивление церебральных сосудов [2; 9].
Измерение ЦПД.
В нормальных физиологических условиях ВЧД близко к давлению венозных синусах мозга, поэтому ЦПД при нормальном состоянии приравнивается артерио-венозному градиенту. При патологических состояниях мозга сопровождающихся повышенным давлением в полости черепа: отеке мозга, нарушении циркуляции ликвора, появлении патологического масс-эффекта — происходит компрессия вен в местах впадения в синусы мозга. Все это приводит к нарушению венозного оттока и, в конечном счете, способствует дальнейшему росту ВЧД. При этом ВЧД значительно превосходит давление в венозных синусах мозга. В создавшихся условиях перфузия ткани мозга будет зависеть от градиента между САД и ВЧД.
Измерение ЦПД возможно при условии измерения артериального и внутричерепного давления. В условиях отделений нейроинтенсивной терапии данные измерения проводятся прикроватного, инвазивно и в непрерывном режиме. Общеизвестно, что для расчета ЦПД используют среднее артериальное давление (САД). Установлено, что САД определяет перфузию тканей организма и остается относительно неизменным на всем протяжении артериального русла [6;42]. Для правильного измерения ЦПД при горизонтальном положении тела датчик измерения инвазивного АД должен располагаться на уровне левого предсердия. При положении тела с приподнятым головным концом датчик должен размещаться на уровне наружного слухового прохода. Так обеспечивается положение датчика на уровне Виллизиева круга сосудов головного мозга, что гарантирует более точное измерение ЦПД [3;41]. Если в положении приподнятого головного конца под углом 15-450 расположить датчик инвазивного артериального давления на уровне левого предсердия, то может происходить искусственное завышение ЦПД на 10-20 мм рт.ст. так как свой вклад будет вносить возросший уровень гидростатического давления. Неправильное измерение ЦПД может влиять на принятие решения о терапии, затруднять своевременную диагностику гипо- и гиперперфузии мозга и, как следствие, ухудшать исходы заболевания [41].
ЦПД и ауторегуляция мозгового кровотока.
Закон Ома позволяет считать ЦПД суррогатным маркером мозгового кровотока [2;9]. Другим не менее значимым фактором, определяющим интенсивность объёмного мозгового кровотока, является сопротивление церебральных сосудов. В норме, у здорового человека работают механизмы ауторегуляции тонуса мозговых сосудов. В соответствии с уравнением Ома, ауторегуляция обеспечивает адекватное сопротивление мозговых сосудов в ответ на изменения ЦПД и, тем самым, поддерживает постоянство объемного кровотока, отвечая метаболическим потребностям мозга [1; 2; 9]. Ауторегуляция тонуса мозговых сосудов – сложный многокомпонентный физиологический механизм регуляции тонуса мозговых сосудов, обеспечивающий адекватность церебрального кровотока, оксигенации и метаболизма. В основе ауторегуляции лежит способность гладкомышечных клеток регионарных сосудов к повышению сократительной активности при увеличении растяжения сосудов под действием перфузионного давления или к ее уменьшению при ослаблении растяжения в условиях снижения перфузионного давления. Основные компоненты ауторегуляции мозговых сосудов – это миогенный, гуморальный, метаболический, нейрогенный, эндотелиальный [1;2;4;5;9].
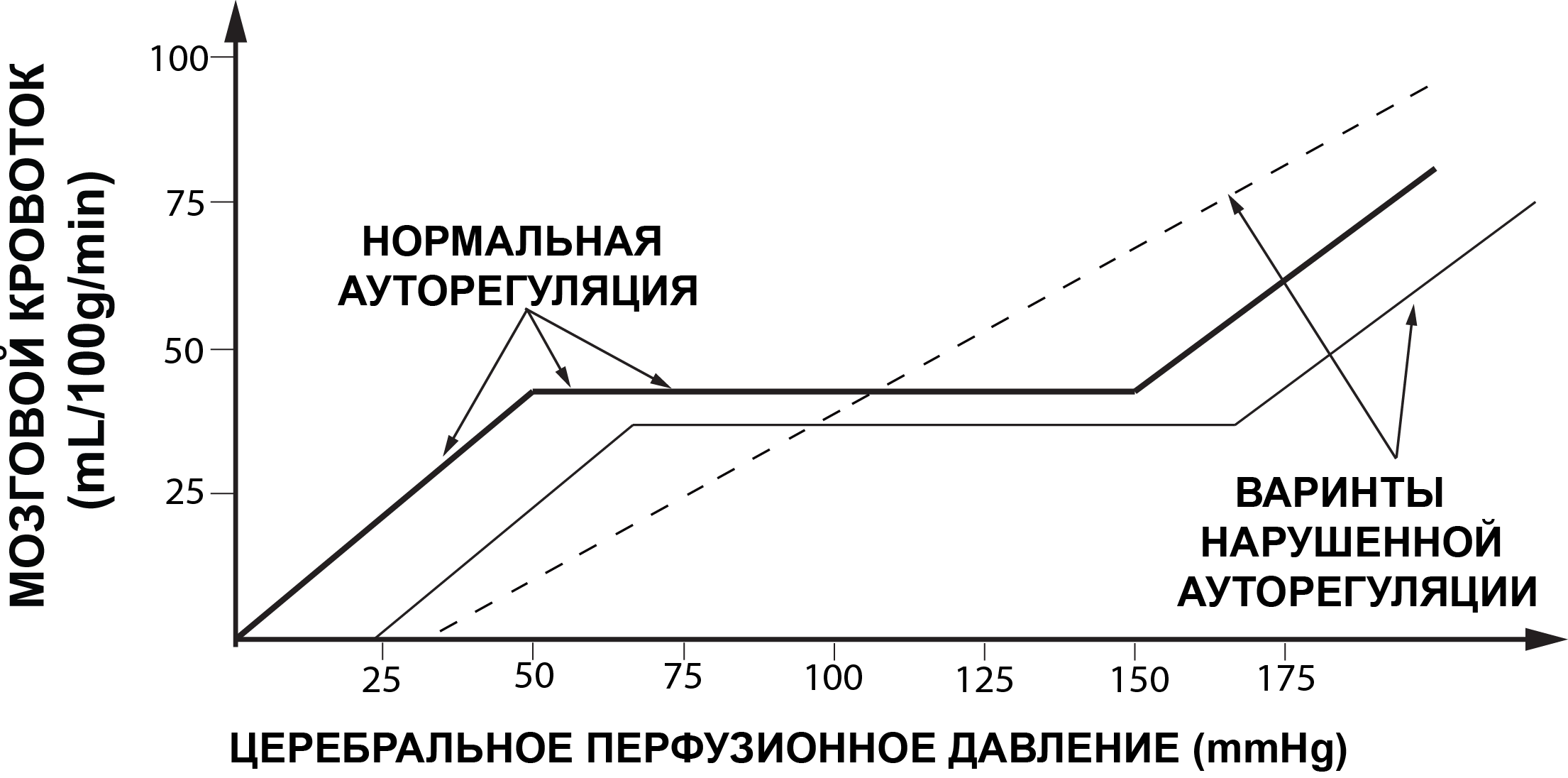
При нормальных физиологических условиях границы ЦПД (Рис. 1) здорового человека лежат в пределах от 50 до 150мм рт.ст.[43]. В пределах указанных границ ЦПД обеспечивается постоянный адекватный объемный мозговой кровоток. Снижение ЦПД ниже 50 мм рт.ст. может приводить к ишемии мозга, а повышение ЦПД выше 150 мм рт.ст. — к гиперемии мозга (Рис. 2).
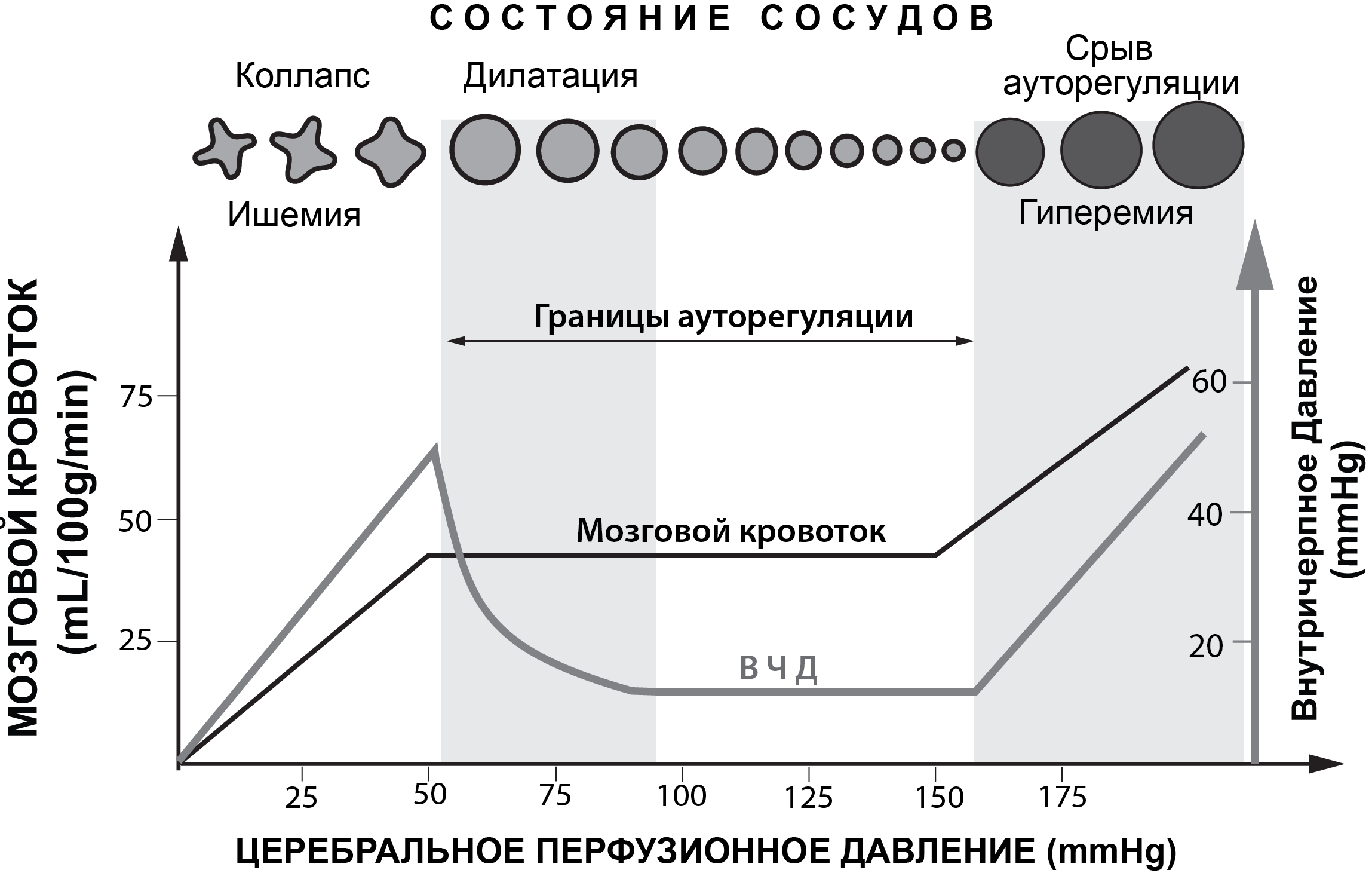
При различных патологических состояниях головного мозга (ЧМТ, САК, ОНМК) ауторегуляция мозговых сосудов может нарушаться. Это означает, что резистивные сосуды плохо обеспечивают постоянство объемного кровотока на фоне изменяющегося АД, изменения газового состава ткани мозга и крови и т.д. В этих патологических условиях мозговой кровоток напрямую зависит от значения ЦПД.
Контроль и обеспечение ЦПД при ЧМТ.
Церебральная ишемия, развивающаяся в остром периоде ЧМТ, остается одним из важных факторов вторичного повреждения мозга, который определяет исход травмы [25;38]. Поддержание церебрального перфузионного давления (ЦПД) у пострадавших с ЧМТ является общепризнанным методом предупреждения развития вторичной ишемии мозга. Согласно данным мировой литературы, ЦПД является независимым прогностическим критерием исхода при ЧМТ [18;37]. Основной причиной снижения церебральной перфузии при ЧМТ является артериальная гипотония. Устранение причин гипоперфузии введено в стандарт оказания первой помощи пострадавших с ЧМТ[29]. Подходы к контролю и обеспечению ЦПД претерпевали изменения, начиная с внедрения первых протоколов лечения пострадавших с ЧМТ. В 60-70-х годах, когда был внедрен мониторинг ВЧД по методу Lunberg, измерению ЦПД не предавалось должного внимания. Основной задачей при ведении пострадавших с ЧМТ считалась коррекция ВЧД. Самый ранний ВЧД-протокол включал в себя такие терапевтические опции, как наружное вентрикулярное дренирование ликвора, гипервентиляцию, использование седативных препаратов, релаксантов, гиперосмолярных растворов и декомпрессивной трепанации [29;36;37;38].
В середине 80-х годов появилась новая концепция ведения пациентов с травматическим поражением головного мозга. В основе концепции, предложенной Rosner et al., лежал каскад вазодилатации и вазоконстрикции. Данная концепция послужила развитию нового направления терапии пострадавших с травматическим поражением головного мозга, а именно, ЦПД-протоколу [48;49;50;51]. По мнению Rosner et al., при ЧМТ границы ауторегуляции мозговых сосудов «смещаются вправо» к более высоким значениям ЦПД. Суть концепции заключается в том, что не зависимо от причин, приводящих к снижению ЦПД, это всегда приводит к вазодилатации мозговых сосудов и увеличению объемного кровотока (внутричерепного содержания крови). Это в свою очередь вызывает повышение ВЧД, что закономерно приводит к дальнейшему снижению ЦПД и, таким образом, причинно-следственный каскад замыкается и повторяется вновь и вновь, приводя к ишемическому повреждение головного мозга. Для разрыва данного патологического круга достаточно повысить перфузионное давление, что приведет к вазоконстрикции мозговых сосудов, уменьшению объемного кровотока и снижению ВЧД. Согласно концепции авторов, для обеспечения адекватного мозгового кровотока и контроля над ВЧД, необходимо поддерживать более высокие значения ЦПД. В дальнейшем ЦПД — протокол был включен в первое международное руководство по ведению ЧМТ и сводился к поддержанию ЦПД выше 70 мм рт.ст. Поддержание ЦПД обеспечивалось инфузионной терапией и введением катехоламинов. Внедрение ЦПД-протокола обеспечило снижение летальности в группе пострадавших с тяжелой ЧМТ с 50% до 35-26% [36;49;55]. Интересно отметить, что с момента внедрения первого ЦПД – протокола и по сегодняшний день произошел пересмотр границ безопасного ЦПД (Таблица №1).

Если на ранних этапах развития делался акцент только на нижние границы допустимого ЦПД, ниже которого считалось нельзя допускать снижения ЦПД из-за риска развития церебральной ишемии, то в настоящее время обсуждается и необоснованность агрессивного обеспечения высоких значений ЦПД. Это обусловлено риском развития различных интра — и экстракраниальных осложнений [15;19].
Альтернативным протоколом по значению безопасного уровня ЦПД является протокол Лунд. Данный протокол, ориентирован на контроль ВЧД. Основной целью протокола является управление внутричерепными объемами за счет снижения транскаппилярной фильтрации, обеспечения целостности гемато-энцефалического барьера, снижения метаболизма мозга, нормализации тонуса прекаппилярных артериол, поддержания коллоидно-онкотического давления. Согласно концепции, высокое АД и повышенное ЦПД являются потенциально опасными, так как провоцируют отек мозга за счет усиления транскаппилярной фильтрации. Терапия ориентирована на снижение АД и понижение ЦПД до 50 мм рт.ст. Обеспечение безопасного уровня ЦПД авторы подтверждали с помощью церебрального микродиализа, контролируя уровень метаболизма мозга [21;26;27]. Разработчики Лунд-протокола утверждали, что он обеспечивает снижение летальности (до 8%) и увеличивает количество благоприятных исходов (до 80%)[21].
Итак, Лунд-протокол был ориентирован на снижение ВЧД 50 мм рт.ст., а другой >70 мм рт.ст. В группе с ЦПД выше 70 мм рт.ст. значительно меньше было эпизодов церебральной ишемии, но при этом не было улучшения исходов заболевания. Авторы связали это с возросшим числом соматических осложнений, чаще в виде респираторного дистресс-синдрома [46].
Таким образом, не было подтверждено преимущество стратегии и положительного эффекта на исходы заболевания при агрессивном обеспечении ЦПД. По результатам этого и ряда других исследований были внесены поправки к существующим рекомендациям по обеспечению ЦПД. Важно отметить, что впервые был ограничен верхний предел ЦПД. Так, согласно последней редакции Guidelines [29], для большинства пострадавших с ЧМТ границы ЦПД должно находиться в пределах 50-70 мм рт.ст. У пострадавших с сохранной ауторегуляцией допускается ЦПД выше 70 мм рт.ст. [29]. ЦПД у пациентов с острым нарушением мозгового кровообращения по ишемическому типу (ОНМК).
Данных о динамике ЦПД и его прогностической значимости у пациентов с ОНМК в литературе практически не встречается. Основной причиной этого является низкая частота встречаемости жизненно угрожающего отека мозга с развитием дислокации. По данным литературы, одно из самых грозных осложнений в виде злокачественного отека при ОНМК в бассейне средней мозговой артерии (СМА) встречается в 10% случаев от всех ишемических инсультов [7;30]. Отсюда следует, что показания для мониторинга ВЧД и ЦПД возникают у этих больных нечасто. В публикациях посвященных интенсивной терапии пациентов с ОНМК неоднократно обсуждался вопрос об адекватности и пользе измерения ВЧД и ЦПД. Так сообщалось, что при полушарных инсультах отрицательная неврологическая симптоматика в виде нарушения сознания, развития гемипареза, афазии, анизокарии, могла развиваться на фоне нормальных значений ВЧД. Ряд авторов достаточно скептически относятся к целесообразности измерения ВЧД и ЦПД при ОНМК и считают, что на данные параметры нельзя ориентироваться при определении лечебной тактики [23;52]. При развитии обширного инфаркта мозга летальность среди пациентов достигала 70-80% даже на фоне мониторинга ВЧД/ЦПД и использовании всего арсенала средств интенсивной терапии: гипервентиляции, седативных препаратов, гиперосмолярных растворов и др. [13;30]. Мета-анализ, проведенный Vahedi et al., на основании трех многоцентровых рандомизированных контролируемых исследований посвященных декомпрессивной трепанации при полушарных инсультах показал, что активная нейрохирургическая тактика снижает летальность и улучшает функциональный исход [54]. Наряду с этим, было сделано важное заключение, что мониторинг ВЧД не влиял на принятие решения о декомпрессивной трепанации. Было так же установлено, что дислокация мозга и неврологическое ухудшение могли развиваться на фоне нормальных значений ВЧД и ЦПД. Таким образом, была показана низкая чувствительность ВЧД мониторинга при выявлении дислокации на фоне ОНМК [54]. В современных рекомендациях по ведению пациентов с ишемическим инсультом основным параметром, обеспечивающим адекватность церебральной гемодинамики, принято считать АД. Артериальная гипотензия при ОНМК встречается редко [17;34]. Установлено, что критическими значениями при ОНМК является АД 100/70 мм рт.ст. [17].
Как следует из вышесказанного, в современной литературе безопасные границы ЦПД при ОНМК не обсуждаются. Это связано с небольшой частотой развития внутричерепной гипертензии у этой категории больных. Злокачественный отек мозга развивается только в 10% случаев от всех инсультов и только при обширных полушарных инфарктах мозга. При данной патологии консервативные методы терапии, ориентированные на ВЧД мониторинг, оказались неэффективными в отличии от декомпрессивной трепанации. В остром периоде ОНМК чаще регистрируется артериальная гипертензия. В международных рекомендациях по лечению больных с инсультом обсуждаются только предельные границы АД, а не границы ЦПД [28]. Так, рекомендуется проводить коррекцию АД только при значениях выше 220/120 мм рт.ст. Коррекция артериальной гипертензии первые 24 часа с момента развития инсульта не должна превышать 15% от исходного значения АД. При показании к внутривенному тромболизису, перед его проведением рекомендуется снизить АД ниже 185/110 мм рт.ст., а после проведения контролировать значение в диапазоне 220 или среднего АД (САД) > 150 мм рт.ст. При развитии отека мозга и систолического АД> 180 и САД> 130 мм рт.ст. коррекция гемодинамики должно проводиться под контролем ВЧД и обеспечения ЦПД>60 мм рт.ст. При отсутствии признаков внутричерепной гипертензии, проводится контроль АД, целевым значением становиться АД 160/90 и САД Сторонние ресурсы
mdtube
ESICM
Critical care news
Внутренние болезни
Нервные болезни
1. Церебральное перфузионное давление
Церебральное перфузионное давление (ЦПД) —
это разница между средним артериальным давлением (АДср) и ВЧД (или церебральным венозным давлением). Если церебральное венозное давление значительно превышает ВЧД, то ЦПД равно разнице между АДср и церебральным венозным давлением. В физиологических условиях ВЧД незначительно отличается от церебрального венозного давления, поэтому принято считать, что ЦПД = = АДср — ВЧД. В норме церебральное перфузионное давление составляет 100 мм рт. ст. и зависит главным образом от АДср, потому что ВЧД у здорового человека не превышает 10 мм рт. ст.
При выраженной внутричерепной гипертензии (ВЧД > 30 мм рт. ст.) ЦПД и MK могут значительно снижаться даже при нормальном АДср. ЦПД + ) плохо проникает через гематоэнцефалический барьер. Что касается PaO2, то на MK оказывают воздействие только его значительные изменения. В то время как гипероксия снижает MK не более чем на 10 %, при тяжелой гипоксии (PaO2 0 C. Гипотермия снижает CMRO2 и MK, в то время как гипер-термия оказывает обратный эффект. Уже при 20 0 C на ЭЭГ регистрируют изолинию, но дальнейшее уменьшение температуры позволяет еще сильнее снизить потребление кислорода мозгом. При температуре выше 42 0 C потребление кислорода мозгом также снижается, что, по-видимому, обусловлено повреждением нейронов.
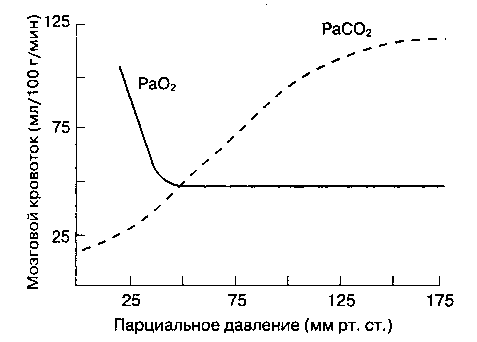
Рис. 25-2. Влияние PaO2 и PaCO2Ha мозговой кровоток
У здоровых людей вязкость крови не оказывает значительного влияния на MK. Вязкость крови
в наибольшей степени зависит от гематокрита, поэтому снижение гематокрита уменьшает вязкость и увеличивает MK. К сожалению, помимо этого благоприятного эффекта, снижение гематокрита имеет и отрицательную сторону: оно уменьшает кислородную емкость крови и, соответственно, доставку кислорода. Высокий гематокрит, например при тяжелой полицитемии, увеличивает вязкость крови и снижает MK. Исследования показали, что для лучшей доставки кислорода к мозгу гематокрит должен составлять 30-34 %.
Вегетативная нервная система
Внутричерепные сосуды иннервируются симпатическими (вазоконстрикторными), парасимпатическими (вазодилатирующими) и нехолинергическими неадренергическими волокнами; нейротрансмитте-ры в последней группе волокон — серотонин и вазо-активный интестинальный пептид. Функция вегетативных волокон сосудов мозга в физиологических условиях неизвестна, но продемонстрировано их участие при некоторых патологических состояниях. Так, импульсация по симпатическим волокнам pis верхних симпатических ганглиев может значительно сузить крупные мозговые сосуды и уменьшить MK. Вегетативная иннервация мозговых сосудов играет важную роль в возникновении церебрального вазоспазма после Ч MT и инсульта.
Между эндотелиальными клетками мозговых сосудов практически отсутствуют поры. Малочисленность пор — основная морфологическая особенность гематоэнцефалического барьера. Липидный барьер проницаем для жирорастворимых веществ, но значительно ограничивает проникновение ионизированных частиц и крупных молекул. Таким образом, проницаемость гематоэнцефалического барьера для молекулы какого-либо вещества зависит от ее размера, заряда, липо-фильности и степени связывания с белками крови. Углекислый газ, кислород и липофильные вещества (к которым относят большинство анестетиков) легко проходят через гематоэнцефалический барьер, в то время как для большинства ионов, белков и крупных молекул (например, маннитола) он практически непроницаем.
Вода свободно проникает через гематоэнцефалический барьер по механизму объемного тока, а перемещение даже небольших ионов затруднено (время полу выравнивания для натрия составляет 2-4 ч). В результате быстрые изменения концентрации электролитов плазмы (а значит, и осмолярности)
вызывают преходящий осмотический градиент между плазмой и мозгом. Остро возникшая гипер-тоничность плазмы приводит к перемещению воды из вещества мозга в кровь. При острой гипотонич-ности плазмы, наоборот, происходит перемещение воды из крови в вещество мозга. Чаще всего равновесие восстанавливается без особых последствий, но в ряде случаев существует опасность быстро развивающихся массивных перемещений жидкости, чреватых повреждением мозга. Следовательно, значительные нарушения концентрации натрия или глюкозы в плазме нужно устранять медленно (см. гл. 28). Маннитол, осмотически активное вещество, которое в физиологических условиях не пересекает гематоэнцефалический барьер, вызывает устойчивое уменьшение содержания воды в мозге и часто используется для уменьшения объема мозга.
Целостность гематоэнцефалического барьера нарушают тяжелая артериальная гипертензия, опухоли мозга, ЧМТ, инсульт, инфекции, выраженная гиперкапния, гипоксия, устойчивая судорожная активность. При этих состояниях перемещение жидкости через гематоэнцефалический барьер определяется не осмотическим градиентом, а гидростатическими силами.
Цереброспинальная жидкость находится в желудочках и цистернах головного мозга, а также в суб-арахноидальном пространстве ЦНС. Главная функция цереброспинальной жидкости — защита мозга от травмы.
Большая часть цереброспинальной жидкости вырабатывается в сосудистых сплетениях желудочков мозга (преимущественно в боковых). Некоторое количество образуется непосредственно в клетках эпендимы желудочков, а совсем небольшая часть — из жидкости, просачивающейся через периваскулярное пространство сосудов мозга (утечка через гематоэнцефалический барьер). У взрослых образуется 500 мл цереброспинальной жидкости в сутки (21 мл/ч), в то время как объем цереброспинальной жидкости составляет только 150 мл. Из боковых желудочков цереброспинальная жидкость через межжелудочковые отверстия (отверстия Монро) проникает в третий желудочек, откуда через водопровод мозга (сильвиев водопровод) попадает в четвертый желудочек. Из четвертого желудочка через срединную апертуру (отверстие Мажанди) и боковые апертуры (отверстия Люшка) цереброспинальная жидкость поступает в мозжечково-мозговую (большую) цистерну (рис. 25-3), а оттуда — в субарахноидальное пространство головного и спинного мозга, где и цир-
кулирует до тех пор, пока не всасывается в грануляциях паутинной оболочки больших полушарий. Для образования цереброспинальной жидкости необходима активная секреция натрия в сосудистых сплетениях. Цереброспинальная жидкость изото-нична плазме, несмотря на более низкую концентрацию калия, бикарбоната и глюкозы. Белок поступает в цереброспинальную жидкость только из перивас-кулярных пространств, поэтому его концентрация очень невелика. Ингибиторы карбоангидразы (аце-тазоламид), кортикостероиды, спиронолактон, фу-росемид, изофлюран и вазоконстрикторы уменьшают выработку цереброспинальной жидкости.

Рис. 25-3. Циркуляция цереброспинальной жидкости в центральной нервной системе. (С разрешения. Из: De-GrootJ., ChusidJ. G. Correlative Neuro anatomy, 21st ed. Appleton & Lange, 1991.)
Цереброспинальная жидкость всасывается в грануляциях паутинной оболочки, откуда попадает в венозные синусы. Небольшое количество всасывается через лимфатические сосуды мозговых оболочек и периневральные муфты. Обнаружено, что всасывание прямо пропорционально ВЧД и обратно пропорционально церебральному венозному давлению; механизм этого явления неясен. Поскольку в головном и спинном мозге нет лимфатических сосудов, всасывание цереброспинальной жидкости — основной путь возвращения белка из интерстициальных и периваскулярных пространств мозга обратно в кровь.
Череп представляет собой жесткий футляр с нерастягивающимися стенками. Объем полости черепа неизменен, его занимает вещество мозга (80 %), кровь (12 %) и цереброспинальная жидкость (8 %). Увеличение объема одного компонента влечет за собой равное по величине уменьшение остальных, так что ВЧД не повышается. ВЧД измеряют с помощью датчиков, установленных в боковом желудочке или на поверхности полушарий головного мозга; в норме его величина не превышает 10 мм рт. ст. Давление цереброспинальной жидкости, измеренное при люмбальной пункции в положении больного лежа на боку, достаточно точно соответствует величине ВЧД, полученной с помощью внутричерепных датчиков.
Растяжимость внутричерепной системы определяют, измеряя прирост ВЧД при увеличении внутричерепного объема. Вначале увеличение внутричерепного объема хорошо компенсируется (рис. 25-4), но после достижения определенной точки ВЧД резко возрастает. Основные компенсаторные механизмы включают: (1) смещение цереброспинальной жидкости из полости черепа в субарахноидальное пространство спинного мозга; (2) увеличение всасывания цереброспинальной жидкости; (3) уменьшение образования цереброспинальной жидкости; (4) уменьшение внутричерепного объема крови (главным образом за счет венозной).
Податливость внутричерепной системы неодинакова в разных участках мозга, на нее влияют АД и PaCO2. При повышении АД механизмы ауторе-гуляции вызывают вазоконстрикцию сосудов мозга и снижение внутричерепного объема крови. Артериальная гипотония, наоборот, приводит к ва-зодилатации сосудов мозга и увеличению внутричерепного объема крови. Таким образом, благодаря ауторегуляции просвета сосудов MK не изменяется при колебаниях АД. При повышении PaCO2 на 1 мм рт. ст. внутричерепной объем крови увеличивается на 0,04 мл/100 г.

Рис. 25-4. Растяжимость внутричерепной системы в норме
Концепцию растяжимости внутричерепной системы широко используют в клинической практике. Растяжимость измеряют при введении стерильного физиологического раствора во внутрижелудоч-ковый катетер. Если после инъекций 1 мл раствора ВЧД увеличивается более чем на 4 мм рт. ст., то растяжимость считают значительно сниженной. Снижение растяжимости свидельствует об истощении механизмов компенсации и служит прогностическим фактором уменьшения MK при дальнейшем прогрессировании внутричерепной гипертензии. Устойчивое повышение ВЧД может вызвать катастрофическую дислокацию и вклинение различных участков мозга. Выделяют следующие виды повреждений (рис. 25-5): (1) ущемление
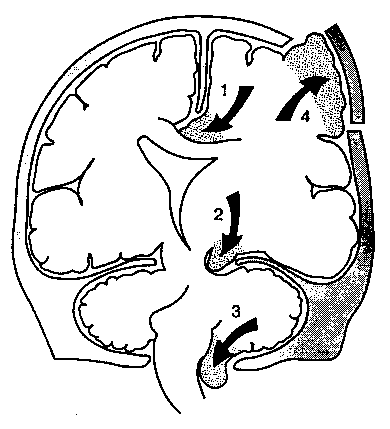
Рис. 25-5. Дислокации головного мозга. (С разрешения. Из: Fishman R. A. Brain edema. New England J. Med., 1975; 293:706.)
поясной извилины серпом мозга; (2) ущемление крючка наметом мозжечка; (3) сдавленна продолговатого мозга при вклинении миндалин мозжечка в большое затылочное отверстие; (4) выпячивание вещества мозга через дефект черепа.
и вспомогательных средств
Подавляющее большинство общих анестетиков благоприятно воздействует на ЦНС, снижая биоэлектрическую активность мозга. Катаболизм углеводов уменьшается, в то время как запасы энергии в виде АТФ, АДФ и фосфокреатина возрастают. Оценить эффект отдельного препарата очень сложно, потому что на него накладывается действие других средств, хирургическая стимуляция, растяжимость внутричерепной системы, АД и PaCO2. Например, гипокапния и предварительное введение тиопентала предотвращают увеличение MK и ВЧД при использовании кетамина pi ингаляционных анестетиков. В этом разделе описано действие каждого препарата в отдельности. Итоговая табл. 25-1 позволяет оценить и сравнить влияние анестетиков и вспомогательных средств на ЦНС. В разделе также обсуждается роль миорелаксантов и средств, оказывающих воздействие на сосудистый тонус.
Источники: http://www.optimed.by/pacientam/blog/arterialnoe-davlenie-perfuzionnoe-davlenie-glaza-i-otkrytougolnaya-glaukoma-u-pacientov-s-sistemnoj-gipertenziej.html, http://nsicu.ru/posts/337, http://studfiles.net/preview/1208949/page:53/